Спирты (алкоголи)
Спиртами называются производные углеводородов, в которых один или несколько атомов водорода заменены на гидроксильные группы -ОН.
(Устойчивыми являются спирты, в молекулах которых группы -ОН связаны с sр3-гибридизованными атомами углерода, причем с каждым атомом углерода связано не более одной группы -ОН).
Классификация спиртов
а) По атомности (т. е. числу гидроксильных групп в молекуле):
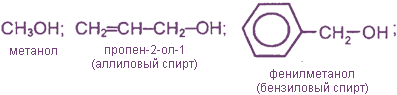
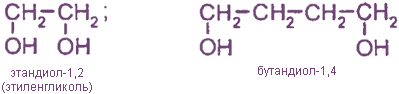
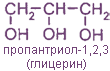
Двух-, трех- и т. д. спирты называются
б) По строению углеводородного радикала: - алифатические предельные и непредельные; например:


в) Алифатические спирты делятся на первичные, вторичные и третичные:
СН3-ОН; СН3-СН2-ОН; СН3-СН2-СН2-ОН
метанол; этанол; пропанол-1.
Предельные одноатомные спирты (алканолы)
Общая формула гомологического ряда предельных одноатомных спиртов -
Изомерия и номенклатура
Изомерия
Изомерия одноатомных спиртов связана со строением углеродного скелета (например, бутанол-2 и 2-метилпропанол-2) и с положением группы ОН (пропанол-1 и пропанол-2).
Номенклатура
Названия спиртов образуют, добавляя окончание -ол к названию углеводорода с самой длинной углеродной цепью, включающей гидроксильную группу. Нумерацию цепи начинают с того края, ближе к которому расположена гидроксильная группа. Кроме того, широко распространена заместительная номенклатура, по которой название спирта производится от соответствующего углеводородного радикала с добавлением, слова "спирт", например: C2H5OH - этанол или этиловый спирт.
Электронное строение молекул алканолов
Молекулы алканолов содержат полярные связи С-Н, С-О, О-Н. Наиболее полярной является связь О-Н; поэтому электронная плотность на атоме водорода в группе ОН оказывается пониженной, а на атоме кислорода - повышенной. Тем не менее, в водных растворах ионизация этой связи не происходит, следовательно, спирты являются
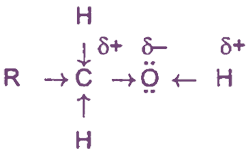
Физические свойства
Первые десять членов гомологического ряда алканолов являются жидкостями, высшие спирты - твердые вещества. Таким образом, спирты обладают аномально высокими температурами кипения по сравнению с алканами. Это объясняется ассоциацией молекул спиртов вследствие образования межмолекулярных водородных связей:
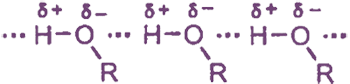
Все алканолы легче воды, бесцветны. Метанол, этанол и пропанол неограниченно растворяются в воде; с увеличением числа атомов углерода растворимость спиртов уменьшается.
Химические свойства алканолов
I. Реакции замещения
1. Замещение атомов водорода в группе -ОН атомами металлов (образуются алкоголяты)
2C2H5O-H + 2Na → 22H6ONa + H2↑
этанол → этилат натрия (этоксид натрия)
Алкоголяты подвергаются практически необратимому гидролизу:
2C2H5ONa + H2O → 22H5OH + HOH
Необратимость этой реакции доказывает, что спирты не проявляют кислотных свойств (точнее, что кислотные свойства спиртов выражены слабее, чем у воды).
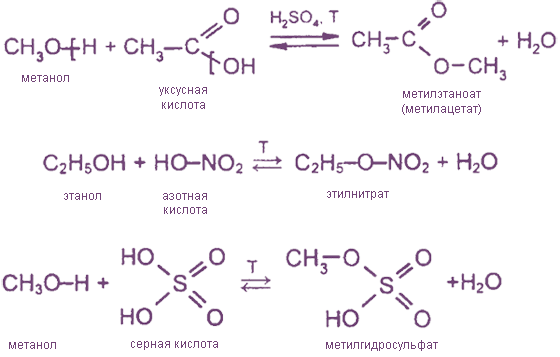
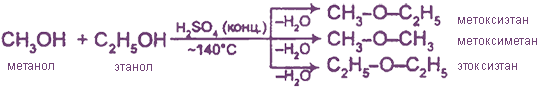
2. Реакции этерификации (образуются сложные эфиры органических и неорганических кислот)
3. Замещение гидроксильной группы на галоген (образуются галогеналканы)
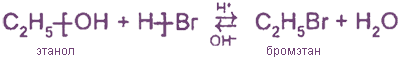
Спирты можно превратить в галогеналканы также действием галогенидов фосфора и тионилхлорида:
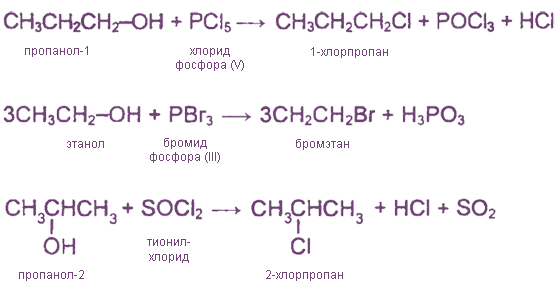


II. Реакции отщепления (элиминирования)

2. Внутримолекулярная дегидратация (образуются апкены)
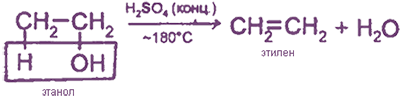

(Правило Зайцева!)

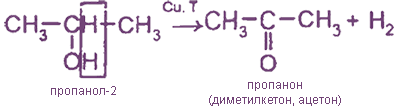
Третичные спирты не дегидрируются.
III. Реакции окисления
(Реакция идет с выделением большого количества теплоты; на этом основано применение лабораторных спиртовок.)
При неполном окислении спиртов образуются те же продукты, что и при их дегидрировании. Таким образом,
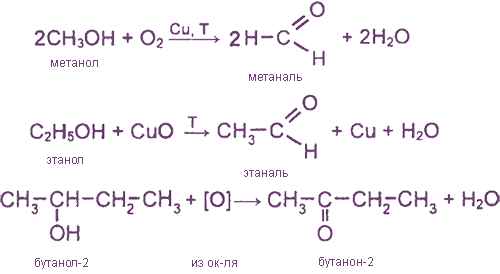
Образующиеся при окислении первичных спиртов альдегиды далее легко окисляются до карбоновых кислот, поэтому можно записывать суммарные уравнения, например:
5С2Н5ОН + 4КМnO4 + 6H2SO4 → 5СН3СООН + 2K2SO4 + 4MnSO4 + 11Н2O
этанол → уксусная кислота
Способы получения алканолов
СН3СН2СН2Вг + КОН → СН3СН2СН2ОН + КВr
1-бромпропан → пропанол-1
(Обратите внимание на отличие этой реакции от взаимодействия галогеналканов со спиртовыми р-рами щелочей, в результате которого образуются алкены.)
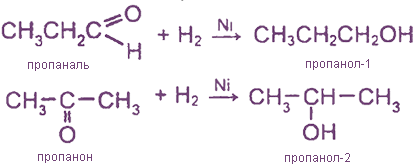
Гидрирование альдегидов и кетонов является их
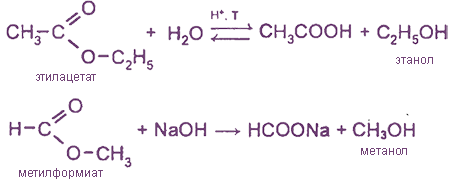
Специфические способы получениия СН3ОН и С2Н5ОН
