Соли
ИЮПАК определяет соли как химические соединения, состоящие из катионов и анионов. Есть ещё одно определение: солями называют вещества, которые могут быть получены при взаимодействии кислот и оснований с выделением воды.
Кроме катионов металлов в солях могут находиться катионы аммония NH4+, фосфония PH4+ и их органические производные, а также комплексные катионы и т. д
Классификация
Если рассматривать соли как продукты протонов в кислотах или гидроксогрупп в основаниях, то можно выделить следующие типы солей:
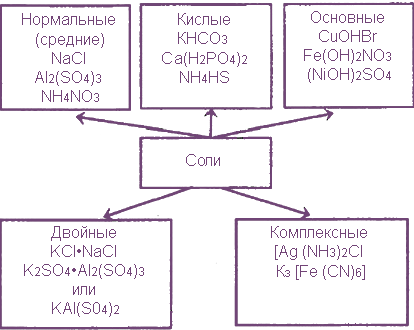
По числу присутствующих в структуре катионов и анионов выделяют следующие типы солей:
Также различают
Номенклатура солей кислородсодержащих кислот
Названия солей, как правило, связаны с названиями соответствующих кислот. Поскольку многие кислоты в русском языке носят тривиальные, или традиционные, названия, подобные названия (нитраты, фосфаты, карбонаты и др.) также сохраняются и для солей.
Традиционные названия солей состоят из названий анионов в именительном падеже и названий катионов в родительном падеже[10]. Названия анионов строятся на основе русских или латинских названий кислотообразующих элементов. Если кислотообразующий элемент может иметь одну степень окисления, то к его названию добавляют суффикс
CO32- - карбонат,
GeO32- - германат.
Если кислотообразующий элемент может принимать две степени окисления, то для аниона, образованного этим элементом в более высокой степени окисления, применяют суффикс -ат, а для аниона с элементов в меньшей степени окисления - суффикс -ит:
SO42- - сульфат,
SO32- - сульфит.
Если элемент может принимать три степени окисления, то для высшей, средней и низшей степени окисления используют соответственно суффиксы -ат, -ит и суффикс -ит с приставкой гипо-:
NO3- - нитрат,
NO2- - нитрит,
NO22- - гипонитрит.
Наконец, в случае элементов, принимающих четыре степени окисления, для высшей степени окисления применяют приставку пер- и суффикс -ат, далее (в порядке понижения степени окисления) суффикс -ат, суффикс -ит и суффикс -ит с приставкой гипо-:
ClO4- - перхлорат,
ClO3- - хлорат,
ClO2- - хлорит,
ClO- - гипохлорит.
Приставки мета-, орто-, поли-, ди-, три-, пероксо- и т. п., традиционно присутствующие в названиях кислот, сохраняются также и в названиях анионов.
Названия катионов соответствуют названиям элементов, от которых они образованы: при необходимости указывается число атомов в катионе (катион диртути(2+) Hg22+, катион тетрамышьяка(2+) As42+) и степень окисления атома, если она переменная.
Названия кислых солей образуются путём добавления приставки гидро- к названию аниона. Если на один анион приходится больше одного атома водорода, то его количество указывают при помощи умножающей приставки (NaHCO3 - гидрокарбонат натрия, NaH2PO4 - дигидрофосфат натрия). Аналогично, для образования названий основных солей используются приставки гидроксо- ((FeOH)NO3 - гидроксонитрат железа(II)).
Кристаллогидратам дают названия, добавляя слово гидрат к традиционному или систематическому названию соли (Pb(BrO3)2·H2O - гидрат бромата свинца(II), Na2CO3·10H2O - декагидрат карбоната натрия). Если известна структура кристаллогидрата, то может применяться номенклатура комплексных соединений ([Be(H2O)4]SO4 - сульфат тетрааквабериллия(II)).
Для некоторых классов солей существуют групповые названия, например, квасцы - для двойных сульфатов общего вида MIMIII(SO4)2·12H2O, где MI - катионы натрия, калия, рубидия, цезия, таллия или аммония, а MIII - катионы алюминия, галлия, индия, таллия, титана, ванадия, хрома, марганца, железа, кобальта, родия или иридия.
Для более сложных или редких солей применяются систематические названия, образующиеся по правилам номенклатуры комплексных соединений. Согласно данной номенклатуре, соль подразделяется на внешнюю и внутреннюю сферы (катион и анион): последняя состоит из центрального атома и лигандов - атомов, связанных с центральным атомом. Название соли формируют следующим образом. Вначале записывают название внутренней сферы (аниона) в именительном падеже, состоящее из названий лигандов (приставок) и центрального элемента (корня) с суффиксом -ат и указанием его степени окисления. Затем к названию добавляют названия атомов внешней сферы (катионов) в родительном падеже.
LiBO3 - триоксоборат(III) лития
Na2Cr2O7 - гептаоксодихромат(VI) натрия
NaHSO4 - тетраоксосульфат(VI) водорода-натрия
Номенклатура солей бескислородных кислот
Для образования названий солей бескислородных кислот пользуются общими правилами составления названий бинарных соединений: применяются либо универсальные номенклатурные правила с указанием числовых приставок, либо способ Штока с указанием степени окисления, причём второй способ является предпочтительным.
Названия галогенидов составляются из названия галогена с суффиксом -ид и катиона (NaBr - бромид натрия, SF6 - фторид серы(VI), или гексафторид серы, Nb6I11 - ундекаиодид гексаниобия). Кроме того, существует класс псевдогалогенидов - солей, которые содержат анионы с галогенидоподобными свойствами. Их названия образуются подобным образом (Fe(CN)2 - цианид железа(II), AgNCS - тиоцианат серебра(I)).
Названия галогенидов составляются из названия галогена с суффиксом -ид и катиона (NaBr - бромид натрия, SF6 - фторид серы(VI), или гексафторид серы, Nb6I11 - ундекаиодид гексаниобия). Кроме того, существует класс псевдогалогенидов - солей, которые содержат анионы с галогенидоподобными свойствами. Их названия образуются подобным образом (Fe(CN)2 - цианид железа(II), AgNCS - тиоцианат серебра(I)).
Халькогениды, содержащие в качестве аниона серу, селен и теллур, называют сульфидами, селенидами и теллуридами. Сероводород и селеноводород могут образовывать кислые соли, которые называют гидросульфидами и гидроселенидами соответственно (ZnS - сульфид цинка, SiS2 - дисульфид кремния, NaHS - гидросульфид натрия). Двойные сульфиды называют, указывая два катиона через дефис: (FeCu)S2 - дисульфид железа-меди.
Электролитическая диссоциация
Практически все соли являются сильными электролитами, т.е. в водных растворах полностью диссоциируют на ионы. Характер диссоциации зависит от типа соли.
Нормальные (средние) соли:
NaCl → Na+ + Сl- хлорид натрия
Al2(SO4)3 → 2Al3++ 3SO42- сульфат алюминия
NH4NO3 → NH4+ + NO3- нитрат аммония
Кислые соли:
KHCO3 → К+ + НСО3- гидрокарбонат калия
Ca(H2PO4)2 → Са2+ + 2Н2РO42- дигидрофосфат кальция
NH4HS → NH4+ + HS- гидросульфид аммония
Основные соли:
CuOHBr → CuOH+ + Br-гидроксобромид меди (II) (бромид гидроксомеди (II))
Fe(OH)2NO3 → Fe(OH)2+ + NO3- дигмдроксонитрат железа (III)
(Ni(OH))2SO4 → 2NiOH+ + SO42- гидроксосульфат никеля (II)
Двойные соли:
K2SO4 • Al2(SO4)3 → 2K+ + 2Al3+ + 4SO42- сульфат калия-алюминия
или:
KAl(SO4)2 → K+ + Al3+ + 2SO42-
Комплексные соли:
[Ag(NH3)2]Cl → [Ag(NH3)2]+ + Cl- хлорид диаммин серебра (I)
K3[Fe(CN)6] → 3K+ + [Fe(CN)6]3- гексацианоферрат (III) калия
Физические свойства
Большинство солей являются твердыми веществами с ионной кристаллической решеткой. Соли s- и р-металпов, как правило, бесцветны. Многие соли d- элементов окрашены.
Растворимость солей в воде варьируется в широких пределах. (См. таблицу растворимости.) Хорошо растворимыми являются практически все соли натрия, калия, аммония; соли азотной кислоты (нитраты), соляной кислоты (хлориды), уксусной кислоты (ацетаты). Плохо растворимы в воде многие фосфаты (соли Н3РO4), карбонаты (соли Н2СO3), сульфиды (соли H2S).
Химические свойства
Характерными для солей являются следующие типы реакций:
1) реакции ионного обмена, в ходе которых катионы или анионы солей образуют малодиссоциирующие или малорастворимые вещества при связывании с ионами реагентов;
2) окислительно-восстановительные реакции, в ходе которых катионы или (и) анионы солей выступают либо в роли окислителей, либо в роли восстановителей;
3) реакции разложения солей, происходящие без переноса электронов.
1. Реакции ионного обмена
Реакции данного типа возможны, если хотя бы один из продуктов реакции представляет собой:
а) слабый электролит;
б) осадок;
в) газообразное вещество.
- Взаимодействие с растворами щелочей (возможны для растворимых солей)
(1) CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Сu2+ + 2OH- = Cu(OH)2
(2) NH4NO3 + KOH = KNO3 + NH3↑ + H2O
NH4+ +OH- = NH3↑ + H2O
(3) Na2CO3 + Ba(OH)2 = 2NaOH + BaCO3↓
CO32- + Ba2+ = BaCO3↓
(4) KHCO3 + KOH = K2CO3 + H2O
HCO3- + OH- = CO32- + H2O
(5) Fe(OH)2Cl + NaOH = Fe(OH)3↓ + NaCl
Fe(OH)2+ + OH- = Fe(OH)3↓
- Взаимодействие с кислотами
(6) Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
CO32- + 2H+ = CO2↑ + H2O
(7) CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
CaCO3 + 2H+ = Ca2+ + CO2↑ + H2O
(8) NaHCO3 + HCl = NaCl + CO2↑ + H2O
HCO3- + H+ = CO2↑ + H2O
(9) Na2S + H2S = 2NaHS
S2- + H2S = 2HS-
(10) MgOHCl + HCl = MgCl2 + H2O
MgOH+ + Н+ = Mg2+ + H2O
(11) AgNO3 + HCl = AgCl↓ + HNO3
Ag+ + Сl- = AgCl↓
(12) BaCl2 + H2SO4 = BaSO4↓ + 2HCl
Ba2+ + SO42- = BaSO4↓
(13) Pb(NO3)2 + H2S = PbS↓ + 2HNO3
Pb2+ + H2S = PbS↓ + 2H+
- Взаимодействие солей друг с другом (возможны для растворимых солей)
(14) AgNO3 + NaCl = AgCl↓ + NaNO3
Ag+ + Сl- = AgCl↓
(15) Ba(NO3)2 + K2SO4 = BaSO4↓ + 2K(NO3
Ba2+ + SO42- = BaSO4↓
(16) CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
Ca2+ + CO32- = CaCO3↓
(17) Zn(NO3)2 + K2S = ZnS↓ + 2KNO3
Zn2+ + S2- = ZnS↓
(18) NH4HCO3 + NaCl = NaHCO3↓ + NH4CI
HCO3- + Na+ = NaHCO3↓
(19) 2К3[Fe(CN)6] + 3FeSO4 = Fe3[Fe(CN)6]2 + 3K2SO4,
2[Fe(CN)6]3- + 3Fe2+ = Fe3[Fe(CN)6]2
(20) FeCl3 + 3NH4SCN ↔ Fe(SCN)3 + 3NH4Cl
Fe3+ + 3SCN- ↔ Fe(SCN)3 (слабый электролит)
Многие обменные реакции являются качественными реакциями на катионы и анионы:
реакция (2) - на катион NH4+; реакции (6, 7, 8) - на анион СO32- ; реакции (11,14) - на катион Аg+ и анион Сl-; реакции (12,15) - на катион Ва2+ и анион SO42- ; реакция (13) - на анион S2-; реакция (19) - на катион Fe2+; реакция (20) - на катион Fe3+.
2. Окислительно-восстановительные реакции
Реакции, в которых катион соли играет роль окислителя
а) взаимодействие растворов солей с металлами (более активные металлы восстанавливают менее активные металлы из растворов их солей):
Cu+2SO4 + Fe = Сu0 + FeSO4
Hg+2(NO3)2 + Сu = Hg0 + Cu(NO3)2
б) взаимодействие растворов солей с другими восстановителями:
2Fe+3Cl3 + 2KI = 2Fe+2Cl2 + l2 + 2KCl
8AgNO3 + PH3 + 4H2O = 8Ag + H3PO4 + 8 HNO3
- Реакции, в которых
2Fe+2Cl2 + Cl2 = 2Fe+3Cl3
4Cr+2Cl2 + 4HCl + O2 = 4Cr+3Cl3 + 2H2O
10Fe+2SO4 + 2KMnO4 + 8H2SO4 = 5Fe+32(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
2Cr+3Cl3 + 3NaBiO3 + 7NaOH + H2 = 2Na2CrO4 + 3Bi(OH)3 + 6NaCl
- Реакции, в которых
2KMn+7O4 + 16HCl = 2Mn+2Cl2 + 5Cl2↑ + 2KCl + 8H2O
K2Cr+72O7 + 3H2O2 + 4H2SO4 = Cr+32(SO4)3 + 3O2 + K2SO4 + 7H2O
2KMn+7O4 + 3C2H4 + 4H2O = 2Mn+4O2↓ + 3C2H4(OH)2 + 2KOH
2KN+5O3 + 3C + S = N02↑ + 3CO2↑ + K2S
2KN+5O3 + 3C + S - черный порох
- Реакции, в которых
2KI-1 + Cl2 = I02 + 2KCl
3PbS-2+ 8HNO3 = 3PbS+6O4 + 8NO + 4Н2O
Na2S+4O3 + I2 + Н2O = Na2S+6O4 + 2HI
2КСr+3O2 + ЗPbO2 + 2КОН = 2K2Cr+6O4 + ЗРbО + Н2O
5KN+3O2 + 2КМnO4 + 3H2SO4 = 5KN+5O3 + 2MnSO4 + K2SO4 + 3H2O
- Реакции, в которых
4Fe+2S-12 + 11O2 = 2Fe+32O3 + 8S+4O2
10Fe+2S-1 + 36HNO3(разб.) = 10Fe+3(NO3)3 + 10S0/sup> + 3N2 + 18H2O
- Реакции
N-3H4N+3O2 = N02↑ + 2H2O
N-3H4N+5O3 = N+12O↑+ 2H2O
2KCl+5O-23 = 2KCl-1 + 3O02↑
2KN+5O-23 = 2KN+3O2 + O02↑
2Cu(N+5O-23)2 = 2CuO + 4N+4O2↑ + O02↑
Ag+1N+5O-23 = 2Ag0 + 2N+4O2↑ + O02↑
2KMn+7O-24 = K2MnO4 + Mn+4O2 + O02↑
3. Реакции разложения солей, происходящие без переноса электронов
Если анион соли не проявляет окислительных свойств, то такие соли, как правило, разлагаются без изменения степеней окисления:
СаСО3 = CaO + CO2↑
Са(HCO3)2 = СаСО3↓ + H2O + CO2↑
Mg(HCO3)2 = Mg(ОH)2↓ + 2CO2↑
(CuOH)2CO3 = 2CuO + CO2↑ + H2O
ZnSO4 = ZnO + SO3↑
(NH4)2SO4 = NH3↑ + NH4HSO4
NH4Cl = NH3↑ + HCl↑
Способы получения солей
Ниже представлены способы получения солей на примере растворимой соли бескислородной кислоты (хлорид натрия) и нерастворимой соли кислородсодержащей кислоты (сульфат бария).
Получение NaCl
1) основание + кислота: NaOH + HCl = NaCl + H2O
2) основной оксид + кислота: Na2O + 2HCl = 2NaCl + H2O
3) металл + кислота: 2Na + 2HCl = 2NaCl + H2↑
4) щелочь + соль: 2NaOH + CuCl2 = 2NaCl + Cu(OH2)↓
5) соль + кислота: Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
6) соль + соль: Na2SO4 + BaCl2 = 2NaCl + BaSO4↓
7) металл + неметалл: 2Na + Cl2 = 2NaCl
8) гидрид + кислота: NaH + HCд = NaCд + H2↑
Получение BaSO4
1) основание + кислота: Ba(OH)2 + H2SO4 = BaSO4↓ + 2H2O
2) основной оксид + кислота: BaO + H2SO4 = BaSO4↓ + H2O
3) металл + кислота: Ba + H2SO4(разб.) = BaSO4↓ + H2↑
4) щелочь + соль: Ba(OH)2 + Na2SO4 = BaSO4↓ + 2NaOH
5) соль + кислота: BaCl2 + H2SO4 = BaSO4↓ + 2HCl
6) соль + соль: Ba(NO3)2 + Na2SO4 = BaSO4↓ + 2NaNO3
7) основной оксид + кислотный оксид: BaO + SO3 = BaSO4↓
8) щелочь + кислотный оксид: Ba(OH)2 + SO3 = BaSO4↓ + H2O
Первые 6 способов получения являются идентичными для обеих солей.