Основания
МеОН ↔ Me+ + ОН- ( Me+ - катион металла)
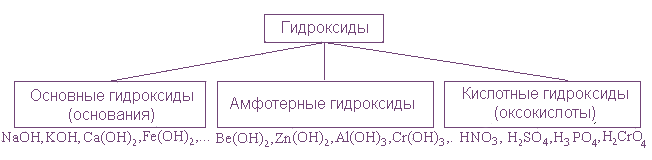
Классификация по кислотности:
- однокислотные ( NaOH , КОН, NH 4 OH и др.);
- двухкислотные (Са(ОН)2, Cu(OH)2, Fe(OH)2;
- трехкислотные ( Ni(OH)3, Со(ОН)3, Мn(ОН)3 .
Классификация по растворимости в воде и степени ионизации:
например:
щелочи - гидроксиды щелочных и щелочноземельных металлов LiOH - гидроксид лития, NaOH - гидроксид натрия (едкий натр), КОН - гадроксид калия (едкое кали), Ва(ОН)2 - гидроксид бария;
например:
Сu(ОН)2 - гидроксид меди (II), Fe(OH)2 - гидроксид железа (II), Ni(OH)3 - гидроксид никеля ( III ).
Химические свойства
- лакмус - синий;
- метилоранж - жёлтый,
- фенолфталеин - малиновый.
2KOH + CO2 = K2CO3 + H2O
KOH + CO2 = KHCO3
NaOH + HNO3 = NaNO3 + H2O; Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Ba(OH)2 + K2SO4 = 2KOH + BaSO4
3KOH + Fe(NO3)3 = Fe(OH)3 + 3KNO3
Cu(OH)2t= CuO + H2O; 2CuOH = Cu2O + Н2O
2Со(ОН)3 = Со2O3 + ЗН2O; 2АgОН = Аg2O + Н2O
например:
4Fe(OH)2 + O2 + 2Н2O = 4Fe(OH)3
2Мn(OН)2 + O2 + 2Н2O = 2Мn(ОН)4
2КОН + Zn(OH)2 = К2[Zn(OH)4]
2КОН + Al2O3 + ЗН2O = 2К[AI(ОН)4]
например:
Zn + 2 NaOH +2Н2O = Na 2[Zn(ОН)4] + Н2↑
2AI +2КOН + 6Н2O= 2КAl(ОН)4] + 3H2↑
например:
Cl2 + 2NaOH = NaCl + NaCIO + Н 2O
3S+ 6NaOH = 2Na2S+ Na2SO3 + 3H2O
4P+ 3KOH + 3H2O = PH3 + 3KH2PO2
например:
C2H5CI + NaOH = С2Н5ОН + NaCl
Способы получения щелочей и нерастворимых оснований
2Na + 2H2O = 2 NaOH + H2↑
Ca + 2H2O = Ca(OH )2 + H2↑
BaO + H2O = Ba(OH)2
2NaCl + 2H2O = 2NaOH + H2↑ + Cl2↑
CaCI 2 + 2Н2O = Са(ОН)2 +Н2 + Cl2
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
FeCI3 + 3KOH = Fe(OH)3 + 3KCI