Оксиды
Классификация и номенклатура
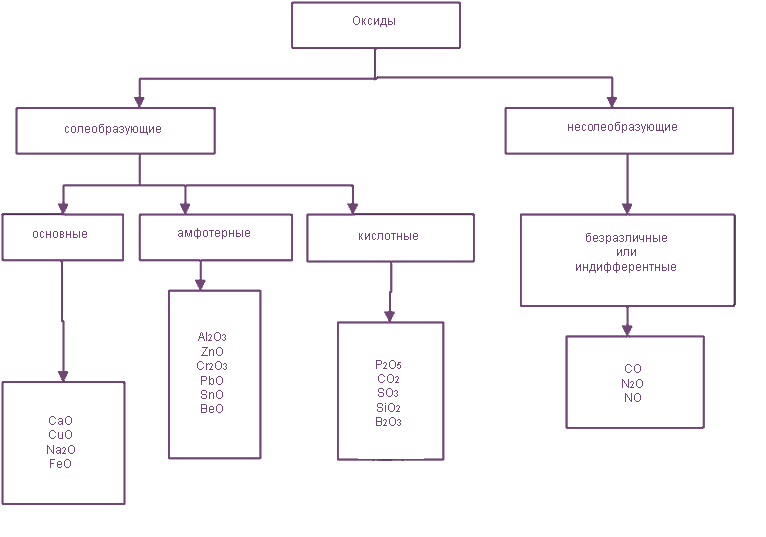
Изменение характера оксидов при увеличении степени окисления металла
Изменение характера оксидов |
Cr+2O (осн.) |
Cr+32O 3(амф.) |
Cr+6O 3(кисл.) |
Mn+2O (осн.) |
Mn+4O2 (амф.) |
Mn+6O3 (кисл.) |
|
Mn+32O3 (осн.) |
Mn+72O 7 (кисл.) |
Физические свойства
Оксиды бывают твердые, жидкие и газообразные, различного цвета. Например: оксид меди (II) CuO черного цвета, оксид кальция СаО белого цвета - твердые вещества. Оксид серы (VI) SO3 - бесцветная летучая жидкость, а оксид углерода (IV) СО2 - бесцветный газ при обычных условиях.
Агрегатное состояние
Твердые:
CaO, СuО, Li2O и др. основные оксиды; ZnO, Аl2O3, Сr2O3 и др. амфотерные оксиды; SiO2, Р2O5, СrO3 и др. кислотные оксиды.
Жидкие:
SO3, Cl2O7, Мn2O7 и др..
Газообразные:
CO2, SO2, N2O, NO, NO2 и др..
Растворимость в воде
Растворимые:
а) основные оксиды щелочных и щелочноземельных металлов;
б) практически все кислотные оксиды (исключение: SiO2).
Нерастворимые:
а) все остальные основные оксиды;
б) все амфотерные оксиды
в) SiO2
Химические свойства
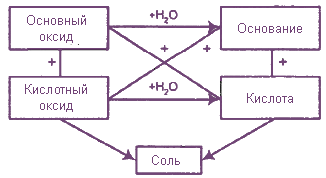
Общими свойствами основных, кислотных и амфотерных оксидов являются кислотно-основные взаимодействия, которые иллюстрируются следующей схемой:
Пример:
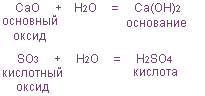
(только для оксидов щелочных и щелочно-земельных металлов) (кроме SiO2).
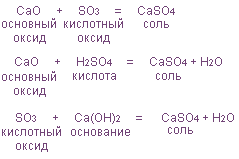
Амфотерные оксиды, обладая свойствами и основных и кислотных оксидов, взаимодействуют с сильными кислотами и щелочами:
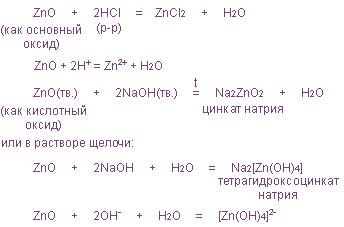
Если элемент имеет переменную степень окисления (с. о.), то его оксиды с низкими с. о. могут проявлять восстановительные свойства, а оксиды с высокими с. о. - окислительные.
Примеры реакций, в которых оксиды выступают в роли восстановителей:
Окисление оксидов с низкими с. о. до оксидов с высокими с. о. элементов.
2C+2O + O2 = 2C+4O2
2S+4O2 + O2 = 2S+6O3
2N+2O + O2 = 2N+4O2
Оксид углерода (II) восстанавливает металлы из их оксидов и водород из воды.
C+2O + FeO = Fe + 2C+4O2
C+2O + H2O = H2 + 2C+4O2
Примеры реакций, в которых оксиды выступают в роли окислителей:
Восстановление оксидов с высокими с о. элементов до оксидов с низкими с. о. или до простых веществ.
C+4O2 + C = 2C+2O
2S+6O3 + H2S = 4S+4O2 + H2O
C+4O2 + Mg = C0 + 2MgO
Cr+32O3 + 2Al = 2Cr0 + 2Al2O3
Cu+2O + H2 = Cu0 + H2O
Использование оксидов малоактивных металлов дпя окисления органических веществ.
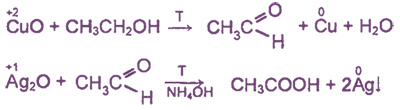
Некоторые оксиды, в которых элемент имеет промежуточную с. о., способны к диспропорционированию;
например:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
Способы получения
1. Взаимодействие простых веществ - металлов и неметаллов - с кислородом:
4Li + O2 = 2Li2O;
2Cu + O2 = 2CuO;
S + O2 = SO2
4P + 5O2 = 2P2O5
2. Дегидратация нерастворимых оснований, амфотерных гидроксидов и некоторых кислот:
Cu(OH)2 = CuO + H2O
2Al(OH)3 = Al2O3 + 3H2O
H2SO3 = SO2↑ + H2O
H2SiO3 = SiO2 + H2O
3. Разложение некоторых солей:
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
CaCO3 = CaO + CO2↑
(CuOH)2CO3 = 2CuO + CO2↑ + H2O
4. Окисление сложных веществ кислородом:
CH4 + 2O2 = CO2 + H2O
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
4NH3 + 5O2 = 4NO + 6H2O
5.Восстановление кислот-окислителей металлами и неметаллами:
Cu + H2SO4 (конц) = CuSO4 + SO2↑ + 2H2O
10HNO3 (конц) + 4Ca = 4Ca(NO3)2 + N2O↑ + 5H2O
2HNO3 (разб) + S = H2SO4 + 2NO↑
6. Взаимопревращения оксидов в ходе окислительно-восстановительных реакций (см. окислительно-восстановительные свойства оксидов).