Общая характеристика металлов
1. Положение в периодической таблице, строение атомов металлов.
2. Характерные физические свойства металлов.
3. Общие химические свойства.
1. Положение в периодической таблице, строение атомов металлов.
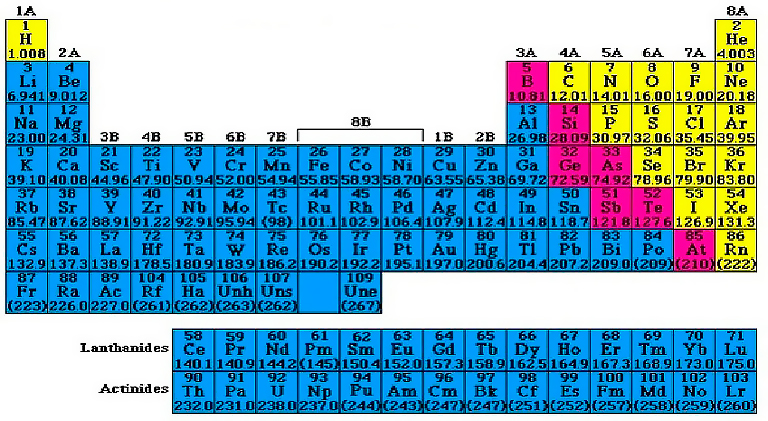
Металлы в периодической системе химических элементов Д.И.Менделеева находятся в левом нижнем углу по диагонали B-At, а далее в побочных подгруппах. Исключение: Н, Ве, В.
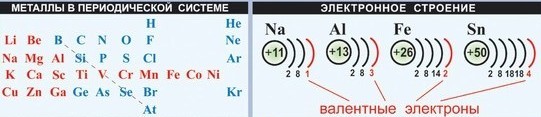
У металлов на последнем электронном слое от 1 до 3 электронов, следовательно, степень окисления от +1 до +3 . Могут иметь степень окисления: +4, +5, +6, +7 металлы главных ( IV - VI ) и побочных подгрупп.
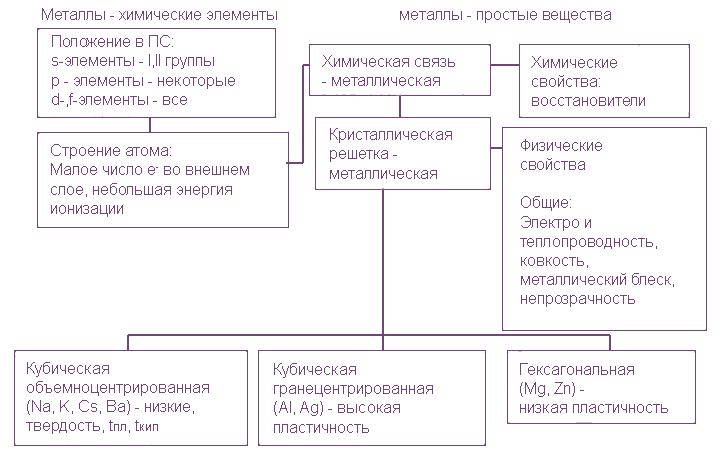
Восстановительные свойства в периоде ослабевают, радиус атома уменьшается , т.к. количество электронов на внешнем слое увеличивается. Увеличивается заряд ядра.
Восстановительные свойства в группе усиливаются . Число электронов на внешнем электронном уровне не изменяется. Радиус атома увеличивается, следовательно металлические свойства усиливаются.
2. Характерные физические свойства металлов.
- Металлический блеск (характерен не только для металлов: его имеют и неметаллы йод и углерод в виде графита);
- Хорошая электропроводность;
- Возможность лёгкой механической обработки - пластичность; однако, некоторые металлы, например германий и висмут, непластичны;
- Высокая плотность (обычно металлы тяжелее неметаллов);
- Высокая температура плавления (исключения: ртуть, галлий и щелочные металлы);
- Большая теплопроводность;
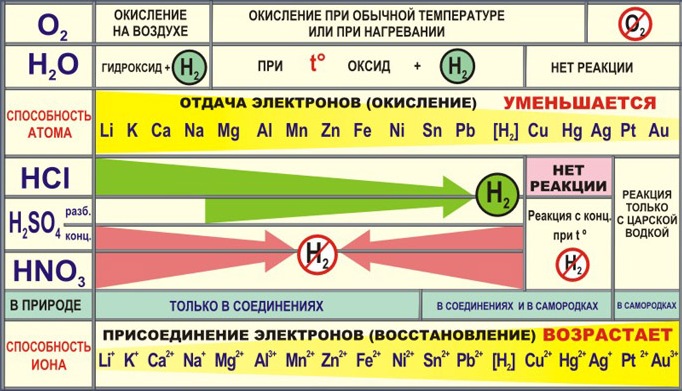
- В реакциях всегда являются восстановителями.
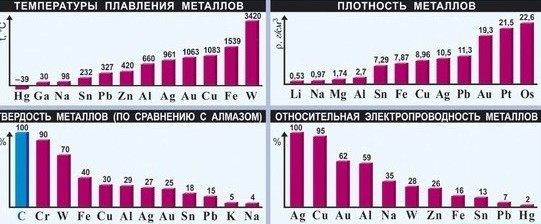
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако они обладают различной твёрдостью. Так, щелочные металлы легко режутся кухонным ножом, а такие металлы, как ванадий, вольфрам и хром легко царапают самую твёрдую сталь и стекло.
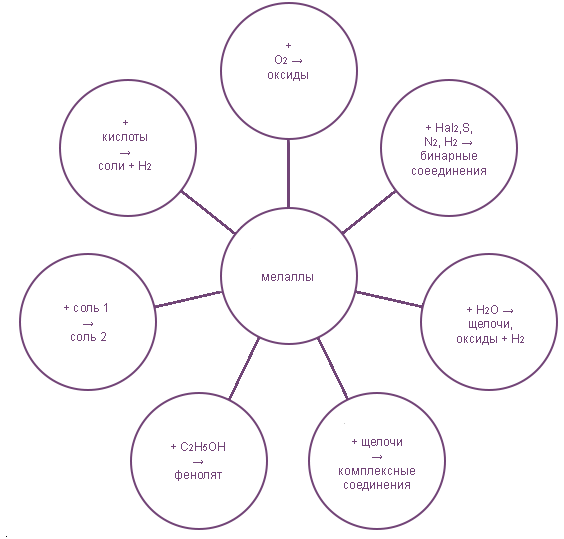
3. Общие химические свойства.