Разновидности химической связи
Внешние оболочки всех элементов, кроме благородных газов, являются НЕЗАВЕРШЕННЫМИ и в процессе химического взаимодействия они ЗАВЕРШАЮТСЯ.
Химическая связь образуется за счет электронов внешних электронных оболочек, но осуществляется она по-разному.
Различают три основных типа химической связи:
- ковалентную связь и ее разновидности: полярную и неполярную ковалентную связь;
- ионную связь;
- металлическую связь.
Ионная связь
Ионная химическая связь – это связь, образовавшаяся за счет электростатического притяжения катионов к анионам.
Ионная связь возникает между атомами, резко отличающимися друг от друга величинами электроотрицательности, поэтому пара электронов, образующая связь, сильно смещена к одному из атомов, так что можно считать её принадлежащей атому этого элемента.
Электроотрицательность - это способность атомов химических элементов притягивать к себе свои и чужие электроны.
Природу ионной связи, структуру и свойства ионных соединений объясняют с позиции электростатической теории химических связей.
Образование катионов: М0 - n e- = Mn+
Образование анионов: НеМ0 + n e- = НеMn-
Например: 2Na0 + Cl20 = 2Na+Cl-
При горении металлического натрия в хлоре в результате окислительно -восстановительной реакции образуются катионы сильно электроположительного элемента натрия и анионы сильно-электроотрицательного элемента хлора.
Вывод: ионная химическая связь образуется между атомами металла и неметалла, сильно отличающимися по электроотрицательности.
Например: CaF2 KCl Na2O MgBr2 и т. д.
Ковалентная неполярная и полярная связи
Ковалентной связью называется связывание атомов с помощью общих (поделенных между ними) электронных пар.
Ковалентная неполярная связь
Рассмотрим возникновение ковалентной неполярной связи на примере образования молекулы водорода из двух атомов водорода. Этот процесс уже является типичной химической реакцией, потому что из одного вещества (атомарного водорода) образуется другое - молекулярный водород. Внешним признаком энергетической "выгодности" этого процесса является выделение большого количества теплоты.
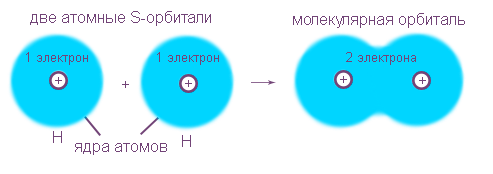
Электронные оболочки атомов водорода (с одним s-электроном у каждого атома) сливаются в общее электронное облако (молекулярную орбиталь), где оба электрона "обслуживают" ядра независимо от того, "свое" это ядро или "чужое". Новая электронная оболочка подобна завершенной электронной оболочке инертного газа гелия из двух электронов:1s2.
На практике используют более простые способы. Например, американский химик Дж. Льюис в 1916 году предложил обозначать электроны
Рассмотрим связывание двух атомов хлора 17Cl (заряд ядра Z = 17) в двухатомную молекулу с позиций строения электронных оболочек хлора.
На внешнем электронном уровне хлора содержится s2 + p5 = 7 электронов. Поскольку электроны нижних уровней не принимают участия в химическом взаимодействии, точками обозначим только электроны
После объединения в молекулу из неспаренных электронов двух атомов получается новая электронная пара:
При этом каждый из атомов хлора оказывается в окружении
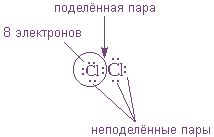
Ковалентную связь образует только пара электронов, находящаяся между атомами. Она называется
По теории Льюиса и правилу октета связь между атомами может осуществляться не обязательно одной, но и
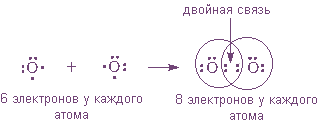
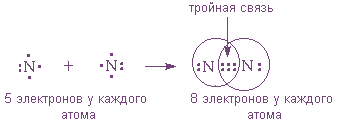
Например: в молекулах H2 Cl2 N2 P4 Br2 - ковалентная неполярная связь.
Ковалентная связь
В качестве примера рассмотрим образование воды в реакции между атомами водорода (Z = 1) и кислорода (Z = 8). Для этого удобно сначала записать электронные формулы для внешних оболочек водорода (1s1) и кислорода (...2s2 2p4).
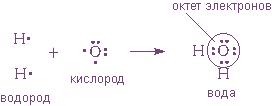
Оказывается, для этого необходимо взять именно два атома водорода на один атом кислорода. Однако природа такова, что акцепторные свойства атома кислорода выше, чем у атома водорода (о причинах этого - чуть позже). Поэтому связывающие электронные пары в формуле Льюиса для воды слегка смещены к ядру атома кислорода. Связь в молекуле воды - полярная ковалентная, а на атомах появляются частичные положительные и отрицательные заряды.
Структурные формулы
В настоящее время принято изображать электронные пары (то есть химические связи) между атомами
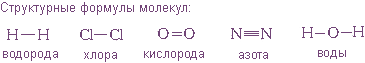
Структурные формулы очень хороши для изображения молекул: они четко показывают - как атомы связаны между собой, в каком порядке, какими связями.
Двойные и тройные связи имеют общее название -