Качественные реакции неорганических и органических веществ
Качественные реакции неорганических веществ
Качественные реакции для газов
Вещество |
Реактив |
Реакция |
Характерные признаки |
Н2 |
О2 (сжигание) |
2Н2 + О2 = 2Н2О |
Запотевание холодного предмета |
О2 |
С (тлеющая лучинка) |
С + О2 = СО2 |
Вспышка |
Сl2 |
Бумажка, пропитанная крахмальным клейстером и раствором иодида калия |
2KI + Cl2 = 2KCl + I2↓ |
Посинение бумажки |
I2 |
Крахмальный клейстер |
Синее окрашивание |
|
СО2 |
Известковая вода |
Са(ОН)2 + СО2 = СаСО3↓+ Н2О |
Помутнение раствора |
NH3 |
Хлороводород |
NH3 + HCl = NH4Cl |
Белый дым. Специфический запах NH3, образование белого дыма (NH4Cl) |
Качественные реакции щелочных металлов
Все соединения щелочных металлов определяют по цвету пламени:
(указан так же цвет пламени некоторых щелочно-земельных металлов)
Ba2+ |
K+ |
Са2+ |
Li+ |
Na+ |
Sr2+ |
желто-зеленое |
фиолетовое |
кирпично-красное |
ярко-красное |
желтое |
карминово-красное |
Качественные реакции на катионы
Катион |
Реактив |
Реакция |
Характерные признаки |
Н+ |
Лакмус Метилоранж |
Красное окрашивание Розовое окрашивание |
|
Ва2+ |
Растворимые сульфаты, серная кислота. |
Ba2+ + SO42- = BaSO4↓ |
Белый мелкодисперсный осадок BaSO4, нерастворимый в H2O и HNO3. |
Ag+ |
Растворимые хлориды, соляная кислота |
Ag+ + Cl- = AgCl↓ |
Белый творожистый осадок AgCl, нерастворимый в H2O и HNO3 |
NH4+ |
Раствор щелочи, нагревание, влажная фильтровальная бумажка, пропитанная лакмусом или фенолфталеином; палочка, смоченная HCl(конц) |
NH4+ + OH- = NH4OH (NH3↑ + HO2) |
Специфический запах аммиака. Изменение окраски бумажки. Палочка, смоченная HCl(конц) «дымит» |
Al3+ |
Растворы щелочи, кислоты |
Al3+ + 3OH- = Al(OH)3↓ |
Белый осадок Al(OH)3, растворимый в кислоте в избытке щелочи |
Zn2+ |
Растворы щелочи, кислоты |
Zn2+ + 2OH- = Zn(OH)2↓ |
Белый осадок Zn(OH)2, растворимый в кислоте в избытке щелочи |
Mg2+ |
Раствор щелочи |
Mg2+ + 2OH- = Mg(OH)2↓ |
Белый осадок Mg(OH)2, нерастворимый в избытке щелочи |
Cr3+ |
Растворы щелочи, кислоты |
Cr3+ + 3OH- = Cr(OH)3↓ |
Cеро-зеленый осадок Cr(OH)3, растворимый в кислоте в избытке щелочи |
Fe2+ |
Раствор красной кровяной соли K3[Fe(CN)6] |
3Fe2++2[Fe(CN)6]3- = Fe3[Fe(CN)6]2↓ |
Образование турнбулевой сини Fe3[Fe(CN)6]2 |
Fe3+ |
Раствор роданида аммония NH4CNS |
Fe3+ + 3CNS- = Fe(CNS)3 |
Кроваво-красное окрашивание раствора Образование берлинской лазури Fe4[Fe(CN)6]3 |
Cu2+ |
Раствор щелочи с последующим нагреванием |
Cu2+ + 2OH- = Cu(OH)2↓ |
Ярко-голубой студенистый осадок, нерастворимый в избытке щелочи, разлагающийся при нагревании на черный осадок CuO и воду |
Качественные реакции на анионы
OH- |
Лакмус |
Синее окрашивание |
|
Фенолфталеин |
Малиновое окрашивание |
||
Метилоранж |
Желтое окрашивание |
||
Cl- |
Раствор нитрата серебра AgNO3 |
Ag+ + Cl- = AgCl↓ |
Белый творожистый осадок, нерастворимый в H2O и HNO3 |
Br- |
Раствор нитрата серебра AgNO3 |
Ag+ + Br- = AgBr↓ |
Светло-желтый осадок, нерастворимый в H2O и HNO3 |
I- |
Раствор нитрата серебра AgNO3 |
Ag+ + I- = AgI↓ |
Желтый осадок, нерастворимый в H2O и HNO3 |
NO3- |
Концентрированная серная кислота и медная стружка при нагревании |
H2SO4+ 2NH4NO3=(NH4)2SO4 + 2HNO3 |
Бурый газ (NO2), голубая окраска раствора |
SO42- |
Раствор соли бария |
Ba2+ + SO42- = BaSO4↓ |
Белый мелкодисперсный осадок, нерастворимый в H2O и HNO3 |
SO32- |
Сильная кислота |
2H+ + SO32- = H2SO3 |
Газ с резким специфическим запахом |
S2- |
Раствор соли свинца |
Pb2+ + S2- = PbS↓ |
Черно-бурый осадок |
CO32- |
Cильная кислота |
2H+ + CO32- = H2CO3 |
Газ без цвета и запаха, не поддерживает горение |
HCO3- |
H+ + HCO3- = H2O + CO2↑ |
||
PO43- |
Раствор нитрата серебра в слабощелочной среде |
3Ag+ + PO43- = Ag3PO4↓ |
Желтый осадок, растворимый в HNO3 |
HPO43- |
3Ag+ + HPO42- = Ag3PO4↓ +H+ |
||
H2PO4 - |
3Ag+ + H2PO4- = Ag3PO4 +2H+ |
Качественные реакции органическиx веществ
Вещество, функциональная группа |
Реактив |
Схема реакции |
Характерные признаки |
Непредельные углеводороды (алкены, алкины, диены), кратные связи |
р-р KMnO4 (розовый) |
СН2=СН2 + Н2О + КMnO4 → КОН + MnO2↓+ СН2(ОН)-СН2(ОН) |
обесцвечивание р-ра |
р-р I2 (бурый) |
СН2=СН-CН3 + I2 → СН2(I)-СН(I)-CH3 |
обесцвечивание р-ра |
|
р-р Br2 (желтый) |
СН2=СН2 + Br2 → СН2(Br)-СН2(Br) |
обесцвечивание р-ра |
|
Ацетилен |
аммиачный р-р Ag2O |
CH ≡ СН + [Ag(NH3)2]OH → AgC≡CAg↓ + NH3↑ + H2O |
образование осадка желтого цвета (взрывоопасен) |
Бензол |
нитрующая смесь HNO3 + H2SO4 |
t0C, H2SO4(конц.) |
образование тяжелой жидкости светло-желтого цвета с запахом горького миндаля |
Толуол |
р-р KMnO4 (розовый) |
C6Н5-СН3 + KMnO4 + H2SO4 → C6Н5-COOH + H2O + K2SO4 + MnSO4 |
обесцвечивание р-ра |
Фенол (карболовая кислота) |
р-р FeCl3 (светло-желтый) |
C6Н5OH + FeCl3 → (C6Н5O)3Fe + HCl |
окрашивание р-ра в фиолетовый цвет |
насыщенный р-р Br2 (бромная вода) |
C6Н5OH + 2Br2 → C6Н2Br3OH↓ + HBr |
образование белого осадка со специфическим запахом |
|
Анилин (аминобензол) |
р-р хлорной извести CaOCl2 (бесцветный) |
окрашивание р-ра в фиолетовый цвет |
|
Этанол |
насыщенный р-р I2 + р-р NaOH |
C2H5OH + I2 + NaOH → CHI3↓ + HCOONa + NaI + H2O |
образование мелкокристаллического осадка СНI3 светло-желтого цвета со специфическим запахом |
CuO (прокаленная медная проволока) |
C2H5OH + CuO → Cu↓ + CH3-CHO + H2O |
выделение металлической меди, специфический запах ацетальдегида |
|
Гидроксогруппа (спирты, фенол, гидроксикислоты) |
Металлический Na |
R-OH + Na → R-O-Na+ + H2↑ |
выделение пузырьков газа (Н2), образование бесцветной студенистой массы |
Эфиры (простые и сложные) |
Н2О (гидролиз) в присутствии NaOH при нагревании |
CH3-C(O)-O-C2H5 + H2O ↔ CH3COOH + C2H5OH |
специфический запах |
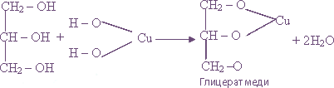
Многоатомные спирты, глюкоза |
Свежеосажденный гидроксид меди (II) в сильно щелочной среде |
|
ярко-синее окрашивание р-ра |
Карбонильная группа – СНО (альдегиды, глюкоза) |
Аммиачный р-р Ag2O |
R-CHO + [Ag(NH3)2]OH → R-COOH + Ag↓ + NH3↑ + H2O |
образование блестящего налета Ag («серебряное зеркало») на стенках сосудов |
Свежеосажденный Сu(OH)2 |
R-CHO + Cu(OH)2 → R-COOH + Cu2O↓ + H2O |
образование красного осадка Сu2O |
|
Карбоновые кислоты |
лакмус |
окрашивание р-ра в розовый цвет |
|
р-р Na2CO3 |
R-COOH + Na2CO3 → R-COO-Na+ + H2O + CO2↑ |
выделение СО2 |
|
спирт +H2SO4(конц.) |
R-COOH + HO-R1 ↔ RC(O)OR1 + H2O |
специфический запах образующегося сложного эфира |
|
Муравьиная кислота |
Свежеосажденный Сu(OH)2 |
HCOOH + Cu(OH)2 → Cu2O↓ + H2O + CO2↑ |
образование красного осадка Сu2O |
Аммиачный р-р Ag2O |
HCOOH + [Ag(NH3)2]OH → Ag↓ + H2O + CO2↑ |
«серебряное зеркало» на стенках сосуда |
|
Олеиновая кислота |
р-р KMnO4 (розовый) или I2 (бурый) или Br2 (желтый) |
C17H33COOH + KMnO4 + H2O →
C8H17-CH(OH)-CH(OH)-(CH2)7-COOH + MnO2↓ + KOH |
обесцвечивание р-ра |
Ацетаты (соли уксусной кислоты) |
р-р FeCl3 |
CH3COONa + FeCl3 → (CH3COO)3Fe + NaCl |
окрашивание р-ра в красно-бурый цвет |
Стеарат натрия (мыло) |
Н2О (гидролиз) + фенолфталеин |
C17H35COONa + H2O ↔ C17H35OOH↓ + NaOH |
окрашивание р-ра в малиновый цвет |
насыщенный р-р соли кальция |
C17H35COONa + Ca2+ ↔ (C17H35COO)2Ca↓ + Na+ |
образование серого осадка |
|
Концентрированная неорганическая кислота |
C17H35COONa + H+ ↔ C17H355COOH↓ + Na+ |
образование белого осадка |
|
Белок |
пламя |
реакция горения |
запах «паленого», жженых перьев |
НNO3 (конц.);t, °С |
ксантопротеиновая реакция (происходит нитрование бензольных колец в молекуле белка) |
без нагревания – появляется желтое окрашивание р-ра; при нагревании и добавлении раствора аммиака белок окрашивается в желтый цвет |
|
Свежеосажденный Сu(OH)2 |
биуретовая реакция (образуется комплексное соединение) |
сине-фиолетовое окрашивание р-ра |