Основные законы химии
Закон сохранения массы веществ. Закон постоянства состава вещества. Химический эквивалент. Закон эквивалентов. Закон объемных отношений. Закон Бойля-Мариотта, Гей-Люссака. Закон Шарля. Объединенный газовый закон. Закон Авогадро. Молекулярные массы газов и паров.
Стехиометрические законы химии:
Pb + O2 = PbO (в реторте)
- С помощью значения относительной плотности были определены относительные молекулярные массы и уточнены составы молекул многих газообразных веществ. Молекулярная масса может быть вычислена также по
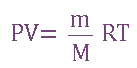 , или
, или ![]()
.png)
P - давление газа в замкнутой системе
V - объем системы (м3)
m - масса газа (кг)
М - молярная масса
Т - абсолютная температура t° в Кельвинах
R - универсальная газовая постоянная
P = 101,325 кПа
Используемые величины:
R = pV/T = 1.01•105•22.4•10-3/273[Па•м3/моль]/K =8.31(44) Дж/(моль•K)
Основные газовые законы химии:
.png) , при t° = const.
, при t° = const.
.png) , при P = const.
, при P = const.
.png) , при V = const.
, при V = const.
.png) , при V = const.
, при V = const.
Если два элемента образуют друг с другом несколько соединений, то на одну и ту же массу одного из них приходятся такие массы другого, которые относятся как небольшие целые числа:
.jpg)
Разделив числа нижней строки на 0,57, видим, что они относятся как 1:2:3:4:5.
2) Хлористый кальций образует с водой 4 кристаллогидрата, состав которых выражается формулами: CaCl2•H22O, CaCl2•2H2O, CaCl2•4H2O, CaCl2•6H2O, т. е. во всех этих соединениях массы воды, приходящиеся на одну молекулу CaCl2, относятся как 1: 2: 4: 6.
.png) , при t° = const.
, при t° = const.
Химический эквивалент кислоты равен её молярной массе, деленной на основность (число ионов водорода) кислоты.
Химический эквивалент основания равен его молярной массе, деленной на кислотность (число гидроксильных групп) основания.
Химический эквивалент соли равен её молярной массе, деленной на сумму зарядов образующих её катионов или анионов.
1. 1 моль любого газа при одинаковых условиях занимает один и тот же объем – равный 22,4 л. (при температуре˚-0˚C и давление 1,01325•105 Па). В этом же объеме находится 6,023•1023 молекул газообразного вещества.
2. Массы равных объемов двух газов, взятых при одинаковом давлении и температуре, относятся друг к другу как их молярные массы:
.png) , также плотности газов относятся как их относительные молекулярные массы:
, также плотности газов относятся как их относительные молекулярные массы: .png) ,
,
Д – относительная плотность.
Периодический закон и периодическая система химических элементов Д.И. Менделеева.
Для правильного написания химических формул надо знать валентность элементов или степень окисления. Валентностью называется способность атомов данного элемента присоединять или замещать определенное число других атомов. max вал. = 8.