Химия
- это наука о веществах, их свойствах и превращениях, происходящих в результате химических реакций, а также о фундаментальных законах, которым эти превращения подчиняются. Поскольку все вещества состоят из атомов, которые благодаря химическим связям способны формировать молекулы, то химия занимается в основном изучением взаимодействий между атомами и молекулами, полученными в результате таких взаимодействий.
Химический элемент
- определённый вид атома имеющий название, порядковый номер, и положение в таблице Менделеева называют химическим элементом. В настоящее время известно 118 химических элементов, заканчивая Uuo (Ununoctium - Унуноктий). Каждый элемент обозначен символом, который представляет одну или две буквы из его латинского названия (водород обозначен буквой H - первой буквой его латинского названия Hydrogenium).
Вещество
- вид материи с определёнными химическими и физическими свойствами. Совокупность атомов, атомных частиц или молекул, находящаяся в определённом агрегатном состоянии. Из веществ состоят физические тела (медь - вещество, а медная монета - физическое тело).
Простое вещество
- вещество, состоящее из атомов одного химического элемента: водород, кислород и т.д.
Сложное вещество
- вещество, состоящее из атомов разных химических элементов: кислоты, вода и др.
Аллотропия
- это способность некоторых химических элементов существовать в виде двух или нескольких простых веществ, различных по строению и свойствам. Например: алмаз и уголь состоят из одного и того же элемента - углерода.
Относительная атомная масса. Относительной атомной массой элемента называют отношение абсолютной массы атома к 1/12 части абсолютной массы атома изотопа углерода 12С. Обозначают относительную атомную массу элемента символом Аr, где r - начальная буква английского слова relative (относительный).
Относительная молекулярная масса. Относительной молекулярной массой Мr называют отношение абсолютной массы молекулы к 1/12 массы атома изотопа углерода 12С.
Обратите внимание на то, что относительные массы по определению являются безразмерными величинами.
Таким образом, мерой относительных атомных и молекулярных масс избрана 1/12 часть массы атома изотопа углерода 12С, которая называется атомной единицей массы (а.е.м.):
Моль.
В химии чрезвычайное значение имеет особая величина - количество вещества.
Количество вещества определяется числом структурных единиц (атомов, молекул, ионов или других частиц) этого вещества, оно обозначается обычно n и выражается в молях (моль).
Моль
- это единица количества вещества, содержащая столько же структурных единиц данного вещества, сколько атомов содержится в 12 г углерода, состоящего только из изотопа 12С.
Число Авогадро. Определение моля базируется на числе структурных единиц, содержащихся в 12 г углерода. Установлено, что данная масса углерода содержит 6,02× 1023 атомов углерода. Следовательно, любое вещество количеством 1 моль содержит 6,02× 1023 структурных единиц (атомов, молекул, ионов).
Число частиц 6,02 × 1023 называется числом Авогадро или постоянной Авогадро и обозначается NA:
NA = 6,02 × 1023 моль-1
Молярная масса. Для удобства расчетов, проводимых на основании химических реакций и учитывающих количества исходных реагентов и продуктов взаимодействия в молях, вводится понятие молярной массы вещества.
Молярная масса M вещества представляет собой отношение его массы к количеству вещества:
где г - масса в граммах, n - количество вещества в молях, М - молярная масса в г/моль - постоянная величина для каждого данного вещества.
Значение молярной массы численно совпадает с относительной молекулярной массой вещества или относительной атомной массой элемента.
Валентность
- способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов или количество связей, которые может образовывать вещество.
Степень окисления
(окислительное число, формальный заряд) - вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов.
Представления о степени окисления положены в основу классификации и номенклатуры неорганических соединений.
Степень окисления соответствует заряду иона или формальному заряду атома в молекуле или в формульной единице, например:
Na+Cl-, Mg2+Cl2-, N-3H3-, C+2O-2, C+4O2-2, Cl+F-, H+N+5O-23, C-4H4+, K+1Mn+7O-24.
Степень окисления указывается сверху над символом элемента. В отличие от указания заряда иона, при указании степени окисления первым ставится знак, а потом численное значение, а не наоборот.
H+N+3O-22 - степень окисления, H+N3+O2-2 - заряды.
Степень окисления атома в простом веществе равна нулю, например:
O03, Br02, C0.
Алгебраическая сумма степеней окисления атомов в молекуле всегда равна нулю:
H+2S+6O-24, (+1 • 2) + (+6 • 1) + (-2 • 4) = +2 +6 -8 = 0
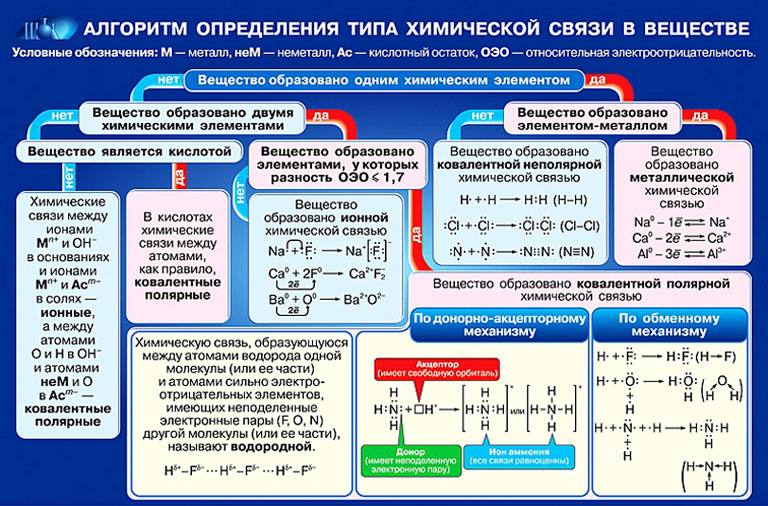
Химическая связь
, взаимное притяжение атомов, приводящее к образованию молекул и кристаллов. Принято говорить, что в молекуле или в кристалле между соседними атомами существуют химические связи. Химическая связь определяется взаимодействием между заряженными частицами (ядрами и электронами). Основные характеристики химической связи - прочность, длина, полярность.
Свойства
- совокупность признаков по которым одни вещества отличаются от других, они бывают химическими и физическими.
Физические свойства
- признаки вещества, при характеристике которых вещество не изменяет свой химический состав.(плотность, агрегатное состояние, температуры плавления и кипения и т.п.)
Химические свойства
- способность веществ взаимодействовать с другими веществами или изменятся под действием определённых условий.Результатом является превращения одного вещества или веществ в другие вещества.
Физические явления - новые вещество не образуется.
Химические явления - новые вещество образуется.
