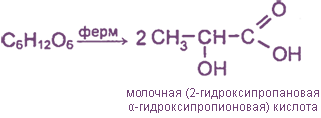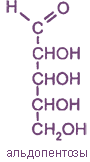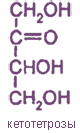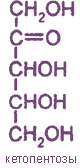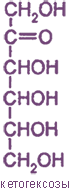Моносахариды
Классификация
По характеру функциональных групп |
По числу атомов углерода |
||
Тетрозы C4H8O4 |
Пентозы C5H10O11 |
Гексозы C6H12O6 |
|
Альдозы (содержат альдегидную группу |
|
|
|
Кетозы (содержат кето-группу) |
|
|
|
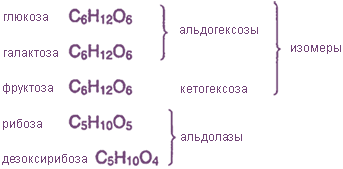
Структура важнейших моносахаридов
Наиболее важными моносахаридами являются:
В водных растворах моносахаридов существуют таутомерные равновесия между их ациклическими и циклическими формами. Циклические формы образуются в результате взаимодействия карбонильной группы и одной из гидроксильных групп с образованием внутренних полуацеталей (см. химические свойства апьдегидов):
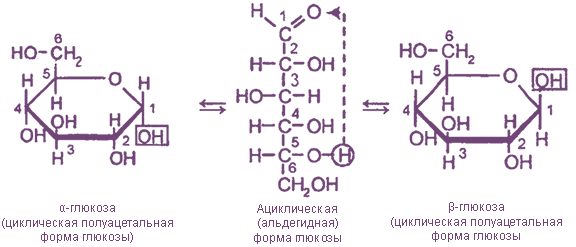
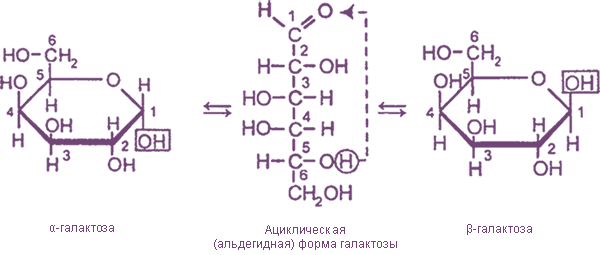
α- и β- глюкоза отличаются пространственным расположением гидроксильной группы у 1-го атома углерода. Этот гидроксил, который образуется в результате присоединения атома водорода к карбонильному атому кислорода, называется полуацетальным, или гликозидным. Аналогичны отличия α- и β- форм других моносахаридов
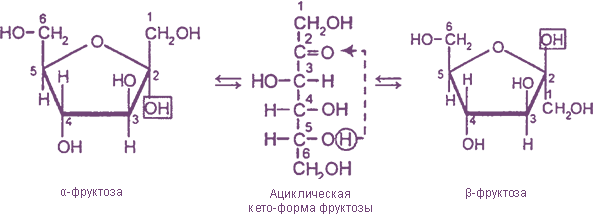
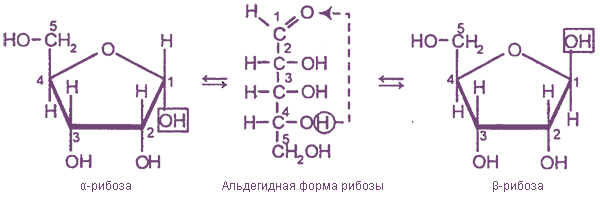
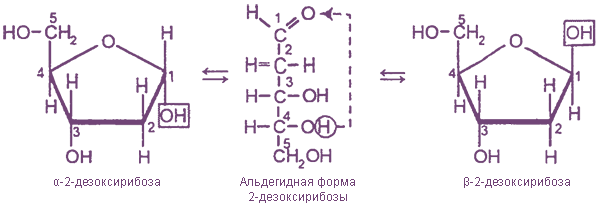
Физические свойства
Моносахариды - твердые кристаллические вещества, хорошо растворимые в воде, имеющие невысокие температуры плавления. Все моносахариды имеют сладкий вкус.
Химические свойства глюкозы
Химические свойства глюкозы, как и других альдоз, обусловлены присутствием в ее молекуле: а) альдегидной группы; б) спиртовых гидроксилов; в) полуацетального (гликозидного) гидроксила.
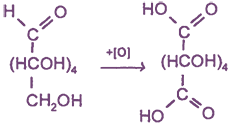
В зависимости от природы окислителя, условий реакции (рН, Т) окислению могут подвергаться не только альдегидная, но и спиртовые группы глюкозы.
Бромная вода окисляет глюкозу до
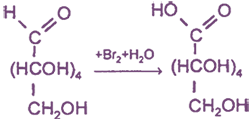
Более сильный окислитель - азотная кислота HNO3 - окисляет глюкозу до
Протекающие в щелочной среде при нагревании реакции с аммиачным раствором Ag2O (реакция «серебряного зеркала») и с гидроксидом меди (II) Сu(ОН)2 приводят к образованию смеси продуктов окисления глюкозы (иногда упрощенно в качестве продукта окисления указывается только глюконовая кислота):
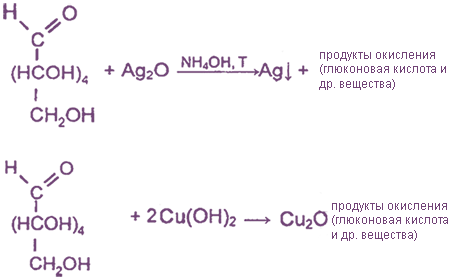
Как и реакции окисления, протекает с участием альдегидной группы глюкозы.
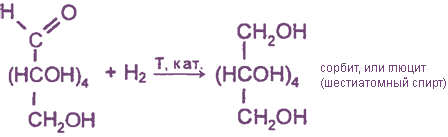
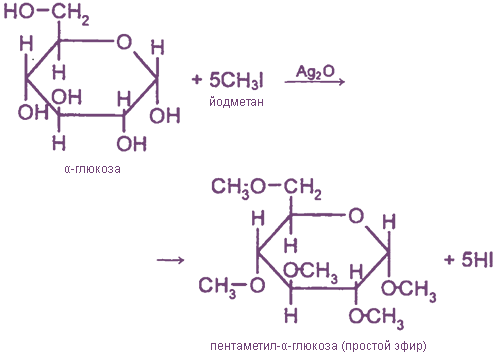
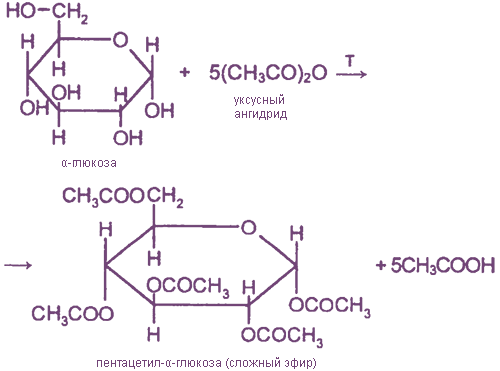
Являясь многоатомным спиртом, глюкоза образует простые и сложные эфиры.
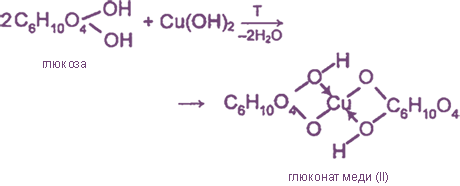
Подобно этиленгликолю и глицерину, глюкоза способна растворять гидроксид меди (II), образуя растворимое комплексное соединение синего цвета:
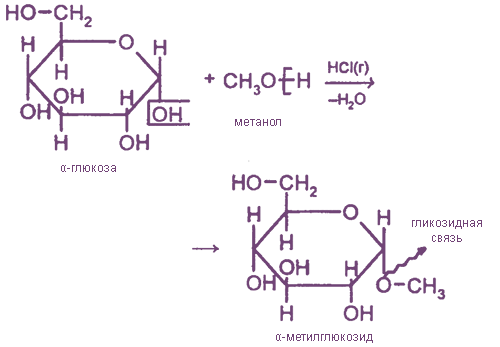
Содержащийся в циклических формах глюкозы полуацетапьный (гликозидный) гидроксил является очень реакционноспособным и легко замещается на остатки различных органических соединений; в результате образуются т. н.
Брожение - процесс разложения моносахаридов под действием ферментов, вырабатываемых различными микроорганизмами. Легче всего брожению подвергается глюкоза.
C6H12O6 → 2C2H5OH + CO2↑