Кетоны
Общая формула и название
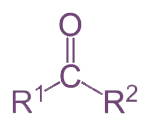
Общая формула кетонов: R1-CO-R2.
По номенклатуре ИЮПАК, названия кетонов образуют путем присоединения к названию соответствующих углеводородов суффикса
Среди других карбонильных соединений наличие в кетонах именно двух атомов углерода, непосредственно связанных с карбонильной группой, отличает их от карбоновых кислот и их производных, а также альдегидов.
Особый класс циклических ненасыщенных дикетонов -
Физические свойства
Простейшие кетоны являются бесцветными, летучими жидкостями, которые растворяются в воде. Кетоны обладают приятным запахом. Высшие кетоны - твердые, легкоплавкие вещества. Газообразных кетонов не бывает, так как уже простейший из них (ацетон) - жидкость. Многие химические свойства, характерные для альдегидов, проявляюся и у кетонов.
Кето-енольная таутомерия
Кетоны, которые имеют по крайней мере один α-водородный атом, подвергаются кето-енольной таутомеризации.
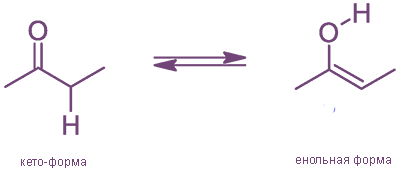
Для оксосоединений, имеющих атом водорода в α-положении по отношннию к карбонильной группе, существует равновесие между таутомерными формами. Для подавляющего большинства оксосоединений это равновесие смещено в сторону кето-формы. Процесс перехода кето-формы в енольную называют
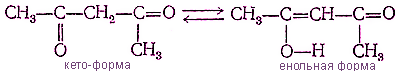
Химические свойства
По степени окисленности кетоны, как и альдегиды, занимают промежуточное положение между спиртами и кислотами, что во многом определяет их химические свойства.
R2CO + 2H → R2CH(OH)
![]()
2R2CO + 2H → R2CH(OH)-CR2(OH)
В отличие от альдегидов, многие кетоны устойчивы при хранении к действию кислорода. Кетоны, содержащие α-метиленовую группу, окисляются SeO2 до 1,2-дикетонов, более энергичными окислителями, напр. КМnО4 - до смеси карбоновых кислот. Циклические кетоны при взаимодействии с HNO3 или КМnО4 подвергаются окислительному расщеплению цикла, например, из циклогексанона образуется адипиновая кислота. Линейные кетоны окисляются надкислотами до сложных эфиров, циклические - до лактонов
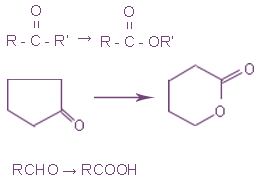
Если в качестве окислителя используют, например, хромовую смесь (смесь концентрированной серной кислоты и насыщенного раствора дихромата калия) при нагревании. Окисление кетонов всегда сопровождается разрывом углерод-углеродных связей, в результате образуется, в зависимости от строения исходного кетона, смесь кислот и кетонов с меньшим числом атомов углерода. Окисление протекает по схеме:
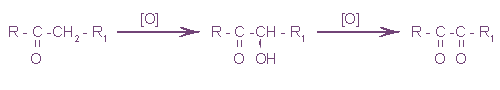
В первую очередь окисляется углерод в α-положении по отношению к карбонильной группе, как правило, наименее гидрогенизированный. Если кетон является метилкетоном, то одним из продуктов его окисления будет углекислый газ. Связь между соседними карбонильными углеродами легко рвется, в результате:
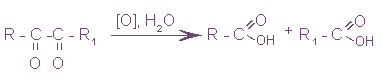
Окисление кетонов до карбоновых кислот не может происходить без расщепления углеродного скелета и требует более жестких условий, чем окисление альдегидов. А. Н. Попов, изучавший окисление кетонов, показал, что из несимметрично построенного кетона при окислении могут образоваться все четыре возможные карбоновые кислоты
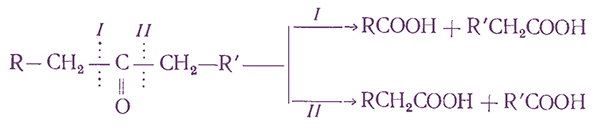
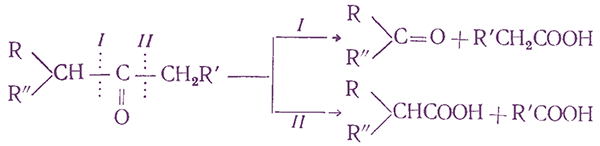
Если кетон содержит в α-положении третичный углеродный атом, то в результате окисления образуются три карбоновые кислоты и новый кетон, который в зависимости от условий может или подвергнуться дальнейшему окислению, или остаться неизмененным:
Кетоны образуют продукты замещения α-атомов Н при галогенировании действием Вr2, N-бромсукцинимидом, SO2Cl2, при тиилировании дисульфидами. При алкилировании и ацилировании енолятов кетонов образуются либо продукты замещения α-атомов Н в кетонах, либо О-производные енолов. Большое значение в органическом синтезе имеют альдольная и кретоновая конденсации, например:
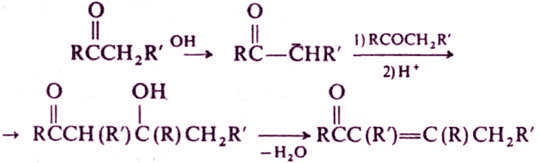
При конденсации с альдегидами кетоны реагируют главным образом как СН-кислоты, например из кетонов и СН2О в присутствии основания получают α, β-ненасыщенные кетоны:
RCOCH3 + СН2О → RCOCH=CH2 + Н2О
Вследствие полярности карбонильной группы
кетоны могут вступать в реакции как С-электрофилы, например при конденсации с производными карбоновых кислот
(CH3)2CO + (C2H5OOCCH2)2 + (CH3)3COK → (CH3)2=C(COOC2H5)CH2COOK + C2H5OH + (CH3)3COH
Особенно легко нуклеофильной атаке подвергаются α,β-непределъные кетоны, но в этом случае атакуется двойная связь
При взаимодействии с илидами Р (алкилиденфосфоранами) кетоны обменивают атом О на алкилиденовую группу
R2C=O + Ph3P=CHR' → R2C=CHR' + Ph3PO
Кетоны способны присоединять по карбонильной группе воду, спирты, бисульфит Na, амины и другие нуклеофилы, хотя эти реакции протекают не так легко, как в случае альдегидов.
Поскольку в спиртовых растворах равновесие между кетоном и его полукеталем сильно смещено влево, получить кетали из кетонов и спиртов трудно:
RCOR' + R"OH ↔ RR'C(OH)OR"
Для этой цели используют реакцию кетонов с эфирами ортомуравьиной кислоты. Кетоны взаимодействуют с С-нуклеофилами, например с литий-, цинк- или магнийорганические соединения, а также с ацетиленами в присутствии оснований
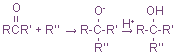
В присутствии оснований к кетонам присоединяется HCN, давая α-гидроксинитрилы (циангидрины):
R2C=O + HCN → R2C(OH)CN
При катализе кислотами кетоны реагируют как С-электрофилы с ароматическими соединениями, например:
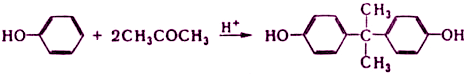
Гомолитическое присоединение кетонов к олефинам приводит к α-алкилзамещенным кетонам, фотоциклoприсоединение к оксетанам, например:
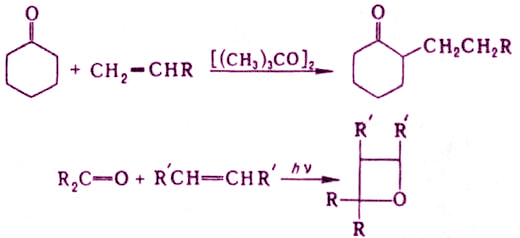
Получение кетонов
1. Окисление спиртов
Кетоны могут быть получены окислением вторичных спиртов. Окислителем, обычно применяемым для этой цели в лабораториях, является хромовая кислота, употребляемая чаще всего в виде «хромовой смеси» (смесь бихромата калия или натрия с серной кислотой). Иногда применяются также перманганаты различных металлов или перекись марганца и серная кислота.
2. Дегидрогенизация (дегидрирование) вторичных спиртов
При пропускании паров спирта через нагретые трубки с мелко раздробленной, восстановленной водородом металлической медью вторичные спирты распадаются - на кетон и водород. Несколько хуже эта реакция проходит в присутствии никеля, железа или цинка.
3. Из одноосновных карбоновых кислот
Кетоны могут быть получены сухой перегонкой кальциевых и бариевых солей одноосновных кислот. Для всех кислот, кроме муравьиной, реакция идет следующим образом:

Чаще восстанавливают не самые кислоты, а их производные, например хлорангидриды:
CH3-CO-Cl + 2H → CH3-CHO + HCl
т. е. образуется кетон с двумя одинаковыми радикалами и карбонат кальция.
Если взять смесь солей двух кислот или смешанную соль, то наряду с предыдущей реакцией происходит также реакция между молекулами разных солей:

Вместо сухой перегонки готовых солей используют также контактный способ, так называемую реакцию кетонизации кислот, состоящую в том, что пары кислот пропускают при повышенной температуре над катализаторами, в качестве которых применяют углекислые соли кальция или бария, закись марганца, окись тория, окись алюминия и др.
Здесь сначала образуются соли органических кислот, которые затем разлагаются, регенерируя вещества, являющиеся катализаторами. В результате реакция идет, например, для уксусной кислоты по следующему уравнению:
2CH3-COOH → CH3-CO-CH3 + H2O + CO2
4. Действие воды на дигалоидные соединения
Кетоны могут получаться при взаимодействии с водой дигалоидных соединений, содержащих оба атома галоида при одном и том же атоме углерода. При этом можно было бы ожидать обмена атомов галоида на гидроксилы и получения двухатомных спиртов, у которых обе гидроксильные группы находятся при одном и том же атоме углерода, например:

Но такие двухатомные спирты в обычных условиях не существуют, они отщепляют молекулу воды, образуя кетоны:
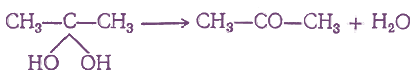
5. Действие воды на ацетиленовые углеводороды (реакция Кучерова)
При действии воды на гомологи ацетилена в присутствии солей окиси ртути, получаются кетоны:
CH3-C≡CH + H2O → CH3-CO-CH3
6. Получение с помощью магний- и цинкорганических соединений
При взаимодействии производных карбоновых кислот с некоторыми металлоорганическими соединениями присоединение одной молекулы металлоорганического соединения по карбонильной группе протекает по схеме:
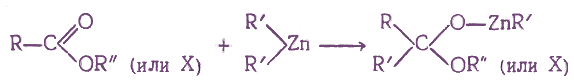
Если на полученные соединения подействовать водой, то они реагируют с ней с образованием в кетонов:
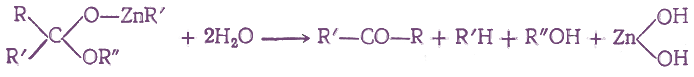
При действии на амид кислоты двух молекул магнийорганического соединения, а затем воды получаются кетоны без образования третичных спиртов:
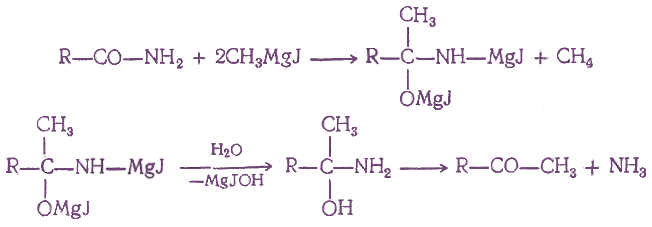
7. Действие кадмийорганических соединений на хлорангидриды кислот
Кадмийорганические соединения взаимодействуют с хлорангидридами кислот иначе, чем магний- или цинкорганические:
R-CO-Cl + C2H5CdBr → R-CO-C2Н5 + CdClBr
Поскольку кадмийорганические соединения не вступают в реакцию с кетонами, здесь не могут получаться третичные спирты.
Применение кетонов
В промышленности кетоны используют как растворители, фармацевтические препараты и для изготовления различных полимеров. Важнейшими кетонами являются ацетон, метилэтиловый кетон и циклогексанон.
Физиологическое действие
Токсичны. Обладают раздражающим и местным действием, проникают через кожу, особенно хорошо ненасыщенные алифатические. Отдельные вещества обладают канцерогенным и мутагенным эффектом. Галогенпроизводные кетонов вызывают сильное раздражение слизистых оболочек и ожоги при контакте с кожей. Алициклические кетоны обладают наркотическим действием.
Кетоны играют важную роль в метаболизме веществ в живых организмах. Так, убихинон участвует в окислительно-восстановительных реакциях тканевого дыхания. К соединениям, содержащим кетонную группу, относятся некоторые важные моносахариды (фруктоза и др.), терпены (ментон, карвон), компоненты эфирных масел (камфора, жасмон), природные красители (индиго, ализарин, флавоны), стероидные гормоны (кортизон, прогестерон), мускус (мускон), антибиотик тетрациклин.
В процессе фотосинтеза 1,5-дифосфат-D-эритро-пентулозы (фосфолированная кетопентоза) является катализатором. Ацетоуксусная кислота - промежуточный продукт в цикле Креббса.
Наличие в моче и крови человека кетонов говорит о гипогликемии, различных расстройствах метаболизма или кетоацидозе.