Фенолы
Классификация фенолов
По числу гидроксильных групп:
- одноатомные; например:
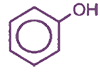
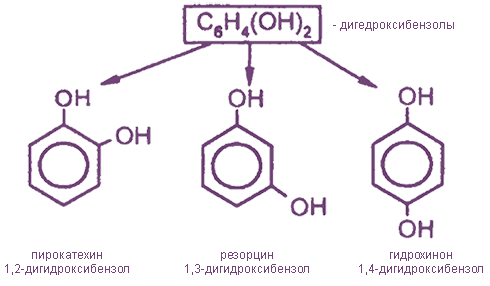
- двухатомные; например:
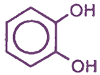
- трехатомные; например:
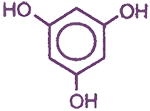
Существуют фенолы и большей атомности.
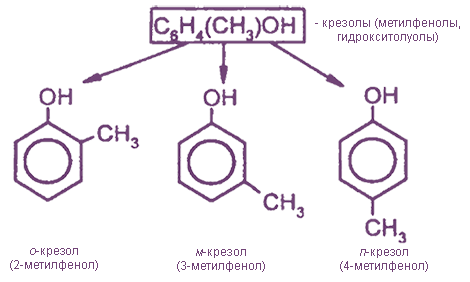
Простейшие одноатомные фенолы
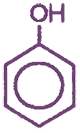
С6Н5ОН — фенол (гидроксибензол), тривиальное название - карболовая кислота.
Простейшие двухатомные фенолы
Электронное строение молекулы фенола. Взаимное влияние атомов в молекуле
Гидроксильная группа -ОН (как и алкильные радикалы) является заместителем 1 рода, т. е. электронодонором. Это обусловлено тем, что одна из неподеленных электронных пар гидроксильного атома кислорода вступает в р, π-сопряжение с π-системой бензольного ядра.
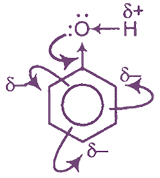
Результатом этого является:
- повышение электронной плотности на атомах углерода в орто- и пара- положениях бензольного ядра, что облегчает замещение атомов водорода в этих положениях;
- увеличение полярности связи О-Н, приводящее к усилению кислотных свойств фенолов по сравнению со спиртами.
В отличие от спиртов, фенолы частично диссоциируют в водных растворах на ионы:

т. е. проявляют слабокислотные свойства.
Физические свойства
Простейшие фенолы при обычных условиях представляют собой низкоплавкие бесцветные кристаллические вещества с характерным запахом. Фенолы малорастворимы в воде, но хорошо растворяются в органических растворителях. Являются токсичными веществами, вызывают ожоги кожи.
Химические свойства
I. Реакции с участием гидроксильной группы (кислотные свойства)
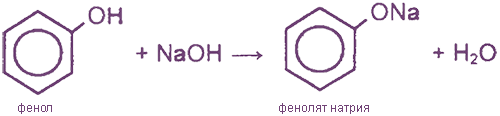
(реакция нейтрализации, отличие от спиртов)
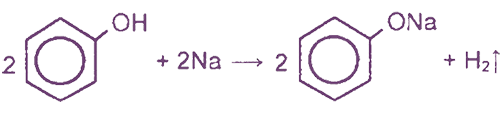
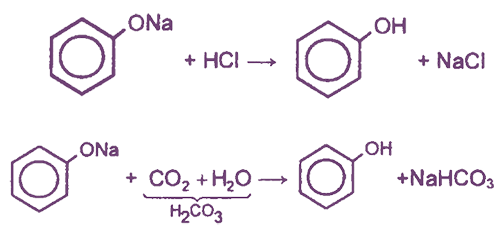
Фенол - очень слабая кислота, поэтому феноляты разлагаются не только сильными кислотами, но даже такой слабой кислотой, как угольная:
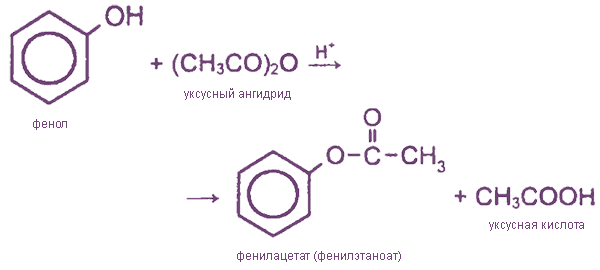
II. Реакции с участием гидроксильной группы (образование сложных и простых эфиров)
Как и спирты, фенолы могут образовывать простые и сложные эфиры.
Сложные эфиры образуются при взаимодействии фенола с ангидридами или хпорангидридами карбоновых кислот (прямая этерификация карбоновыми кислотами протекает труднее):
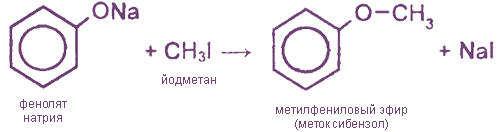
Простые эфиры (алкилариловые) образуются при взаимодействии фенолятов с алкилгалогенидами:
III. Реакции замещения с участием бензольного ядра
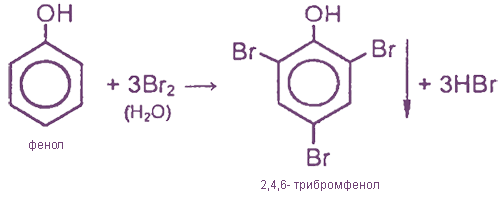
Образование белого осадка трибромфенола иногда рассматривается как качественная реакция на фенол.
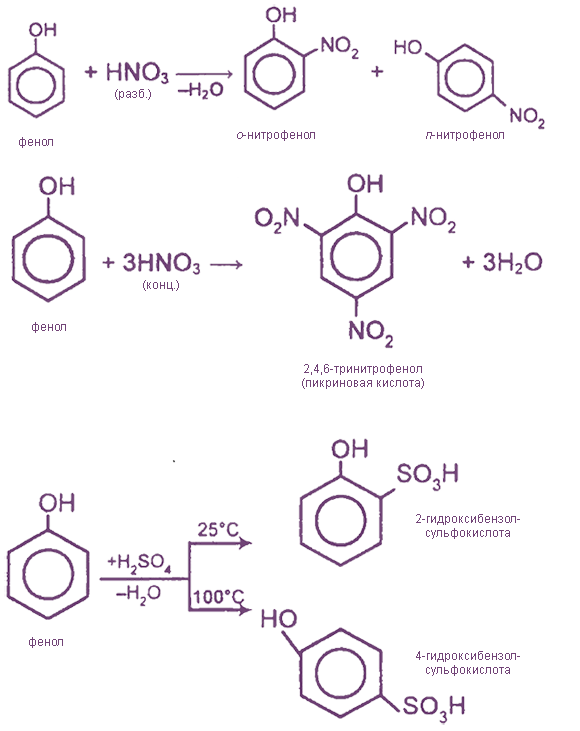
IV. Реакции присоединения (гидрирование)
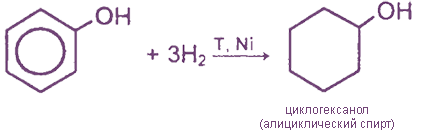
V. Качественная реакция с хлоридом железа (III)
Одноатомные фенолы + FeCl3 (р-р) → Сине-фиолетовая окраска, исчезающая при подкислении.
Многоатомные фенолы + FeCl3 (р-р) → Окраска различных оттенков.
VI. Реакции окисления
При окислении фенола кислородом воздуха образуется гидрохинон

Способы получения фенолов
1. Сплавление солей ароматических сульфокислот со щелочами
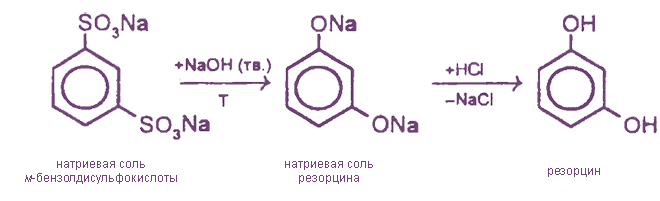
2. Взаимодействие арилгалогенидов со щелочами
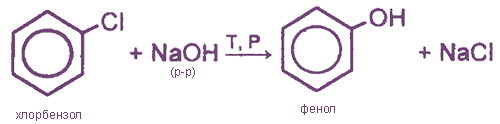
3. Кумольный способ
Наряду с фенолом образуется имеющий важное практическое значение кетон - ацетон.
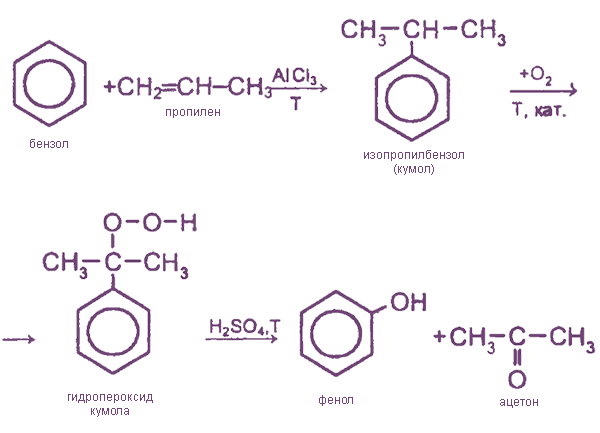
Фенол и ацетон разделяют путем ректификации (фракционной перегонки).