Белки (протеины)
Белки - природные высокомолекулярные соединения (биополимеры), макромолекулы которых состоят из остатков α-аминокислот, соединенных пептидными связями -CO-NH-.
Первичная структура белковых молекул
Под первичной структурой белков понимают
Условно считают, что к белкам относятся полипептиды, содержащие в полипептидной цепи
Соединения с меньшим числом аминокислотных остатков называются
Фрагмент первичной структуры:
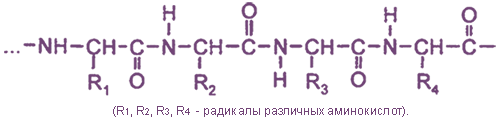
Подсчитано, что из 20 различных аминокислот, которые чаще всего встречаются в составе белков, можно построить примерно 1018 белковых молекул.
Вторичная структура
В результате образования внутримолекулярных водородных связей между атомами водорода аминогрупп и атомами кислорода карбонильных групп полипептидные цепи многих белков скручиваются в
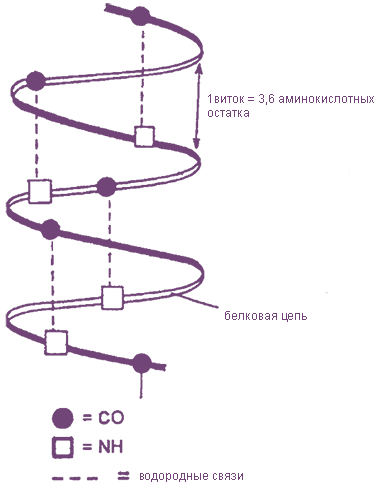
Третичная структура
Третичная структура определяет

Такими связями являются:
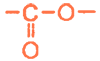 , образующиеся в результате взаимодействия карбоксильной группы в радикалах дикарбоновых кислот и гидроксильной группы в радикалах гидроксиаминокислот;
, образующиеся в результате взаимодействия карбоксильной группы в радикалах дикарбоновых кислот и гидроксильной группы в радикалах гидроксиаминокислот;
Четвертичная структура
Для некоторых белков характерно образование
Например, белок крови - гемоглобин - сложный белок (протеид), макромолекула которого состоит из четырех полипептидных цепей, соединенных с четырьмя небелковыми образованиями -
Эмпирическая формула гемоглобина:
(C738H1166O208N203S2Fe)4
Физические свойства
Природные белки выполняют в организме различные функции и в соответствии с этим обладают разными свойствами: существуют жидкие и твердые белки, растворимые и нерастворимые в воде.
Белки не имеют температуры плавления и температуры кипения, так как большинство из них при нагревании сворачиваются.
При высокой температуре все белки сгорают.
Физико-химические свойства
Как и аминокислоты, белки являются амфотерными соединениями, так как молекула любого белка содержит на одном конце группу -NH2, а на другом конце - группу -СООН. Большее или меньшее число таких групп содержится также в радикалах диамино- и дикарбоновых кислот. Поэтому свойства белков во многом похожи на свойства аминокислот. Однако белки обладают и специфическими физико-химическими свойствами.
1. Гидролиз белков
Переваривание белков в организме по своей сути представляет ферментативный гидролиз белковых молекул. В лабораторных условиях и в промышленности проводится кислотный гидролиз. В любом случае в ходе гидролиза белков происходит разрушение пептидных связей. Гидролиз белка имеет ступенчатый характер:
2. Обратимое осаждение (высаливание)
Белки способны осаждаться из растворов под действием таких веществ, как
3. Необратимое осаждение (денатурация, свертывание)
При действии таких реагентов, как
Пример тепловой денатурации - свертывание яичного белка альбумина при варке яиц.
4. Цветные качественные реакции на белки
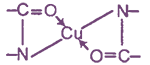
а) Биуретовая реакция - реакция на пептидные связи
Причина появления окраски - образование комплексных соединений с координационным узлом:
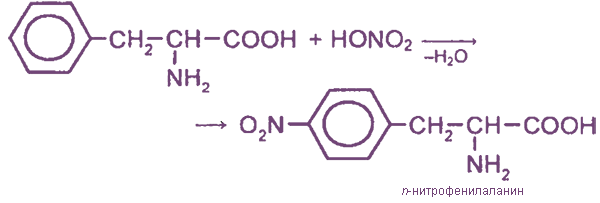
б) Ксантопротеиновая реакция (реакция на радикалы ароматических аминокислот)
Причина появления окраски - образование нитропроизводных ароматических аминокислот, например, фенилаланина.
в) Цистеиновая реакция (реакция на остатки S-содержащих аминокислот)
Причина появления окраски - образование черного осадка сульфида свинца (II) PbS.