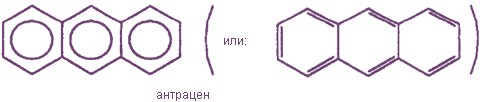Ароматические углеводороды. Бензол и его гомологи
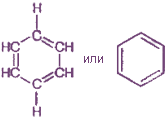
Понятие «бензольное кольцо» сразу требует расшифровки. Для этого необходимо хотя бы коротко рассмотреть строение молекулы бензола. Первая структура бензола была предложена в 1865 г. немецким ученым А. Кекуле:
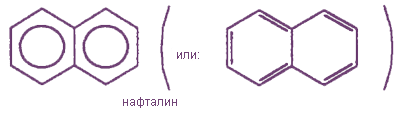
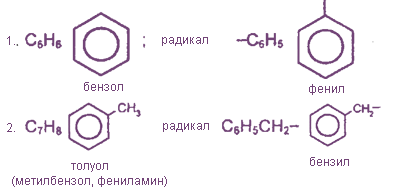
К наиболее важным ароматическим углеводородам относятся бензол С6Н6 и его гомологи : толуол С6Н5СНз, ксилол С6Н4(СНз)2 и др.; нафталин C10H8, антрацен С14Н10 и их производные.
Атомы углерода в молекуле бензола образуют правильный плоский шестиугольник, хотя обычно его рисуют вытянутым.
Окончательно строение молекулы бензола подтверждено реакцией образования его из ацетилена. В структурной формуле изображается по три одинарных и три двойных чередующихся углерод-углеродных связей. Но такое изображение не передает истинного строения молекулы. В действительности углерод-углеродные связи в бензоле равноценны, и они обладают свойствами, не похожими на свойства ни одинарных, ни двойных связей. Эти особенности объясняются электронным строением молекулы бензола.
Электронное строение бензола
Каждый атом углерода в молекуле бензола находится в состоянии sp2-гибридизации. Он связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. В результате образуется плоский шестиугольник: все шесть атомов углерода и все σ-связи С-С и С-Н лежат в одной плоскости. Электронное облако четвертого электрона (р-электрона), не участвующего в гибридизации, имеет форму гантели и ориентировано перпендикулярно к плоскости бензольного кольца. Такие р-электронные облака соседних атомов углерода перекрываются над и под плоскостью кольца.
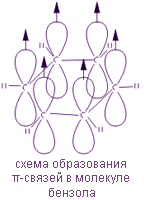
В результате шесть р-электронов образуют общее электронное облако и единую химическую связь для всех атомов углерода. Две области большой электронной плоскости расположены по обе стороны плоскости σ-связей.
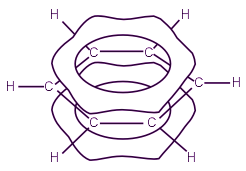
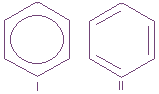
p-Электронное облако обусловливает сокращение расстояния между атомами углерода. В молекуле бензола они одинаковы и равны 0,14 нм. В случае простой и двойной связи эти расстояния составили бы соответственно 0,154 и 0,134 нм. Значит, в молекуле бензола нет простых и двойных связей. Молекула бензола - устойчивый шестичленный цикл из одинаковых СН-групп, лежащих в одной плоскости. Все связи между атомами углерода в бензоле равноценны, чем и обусловлены характерные свойства бензольного ядра. Наиболее точно это отражает структурная формула бензола в виде правильного шестиугольника с окружностью внутри (I). (Окружность символизирует равноценность связей между атомами углерода.) Однако часто пользуются и формулой Кекуле с указанием двойных связей (II):
Бензольное ядро обладает определенной совокупностью свойств, которую принято называть
Гомологический ряд, изомерия, номенклатура
Условно арены можно разделить на два ряда. К первому относят производные бензола (например, толуол или дифенил), ко второму — конденсированные (полиядерные) арены (простейший из них — нафталин):

Гомологический ряд бензола имеет общую формулу СnН2n-6. Гомологи можно рассматривать как производные бензола, в котором один или несколько атомов водорода замещены различными углеводородными радикалами. Например, С6Н5-СН3 - метилбензол или толуол, С6Н4(СН3)2 - диметилбензол или ксилол, С6Н5—С2Н5 - этилбензол и т.д.
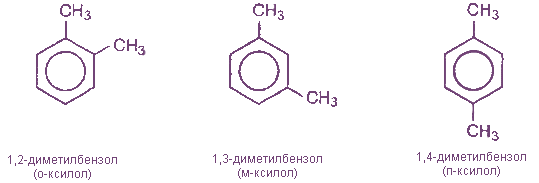
Так как в бензоле все углеродные атомы равноценны, то у первого его гомолога - толуола - изомеры отсутствуют. У второго гомолога - диметилбензола - имеются три изомера, отличающиеся взаимным расположением метильных групп (заместителей). Это орто- (сокращенно о-), или 1,2-изомер, в нем заместители находятся у соседних атомов углерода. Если заместители разделены одним атомом углерода, то это мета- (сокращенно м-) или 1,3-изомер, а если они разделены двумя атомами углерода, то это пара- (сокращенно п-) или 1,4-изомер. В названиях заместители обозначаются буквами (о-, м-, п-) или цифрами.
Физические свойства
Первые члены гомологического ряда бензола - бесцветные жидкости со специфическим запахом. Плотность их меньше 1 (легче воды). В воде нерастворимы. Бензол и его гомологи сами являются хорошими растворителями для многих органических веществ. Арены горят коптящим пламенем ввиду высокого содержания углерода в их молекулах.
Химические свойства
Ароматичность определяет химические свойства бензола и его гомологов. Шестиэлектронная π-система является более устойчивой, чем обычные двухэлектронные π-связи. Поэтому реакции присоединения менее характерны для ароматических углеводородов, чем для непредельных углеводородов. Наиболее характерными для аренов являются реакции замещения. Таким образом, ароматические углеводороды по своим химическим свойствам занимают промежуточное положение между предельными и непредельными углеводородами.
I. Реакции замещения
1. Галогенирование (с Cl2, Вr2)

2. Нитрование
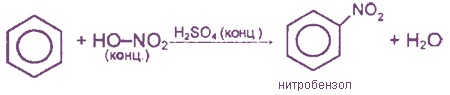
3. Сульфирование
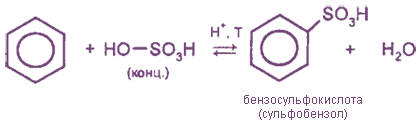
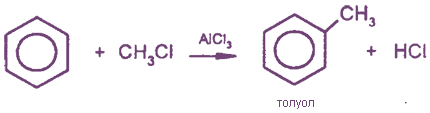
4. Алкилирование (образуются гомологи бензола) - реакции Фриделя-Крафтса
Алкилирование бензола происходит также при его взаимодействии с алкенами:
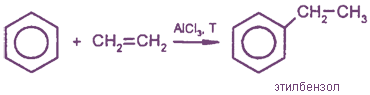
Дегидрированием этилбензола получают стирол (винилбензол):

II. Реакции присоединения
1. Гидрирование
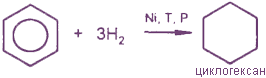
2. Хлорирование

III. Реакции окисления
1. Горение
2С6Н6 + 15O2 → 12СO2 + 6Н2O
2. Окисление под действием КМnO4, К2Сr2O7, HNO3 и др.
Не происходит химической реакции (сходство с алканами).
Свойства гомологов бензола
В гомологах бензола различают ядро и боковую цепь (алкильные радикалы). По химическим свойствам алкильные радикалы подобны алканам; влияние бензольного ядра на них проявляется в том, что в реакциях замещения всегда участвуют атомы водорода у атома углерода, непосредственно связанного с бензольным ядром, а также в более легкой окисляемости С-Н связей.
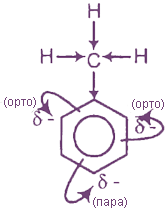
Влияние электронодонорного алкильного радикала (например, -СН3) на бензольное ядро проявляется в повышении эффективных отрицательных зарядов на атомах углерода в орто- и пара-положениях; в результате облегчается замещение связанных с ними атомов водорода. Поэтому гомологи бензола могут образовывать тризамещенные продукты (а бензол обычно образует монозамещенные производные).
I. Реакции с участием боковой цепи
1. Галогенирование
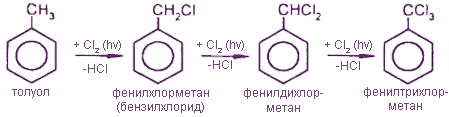
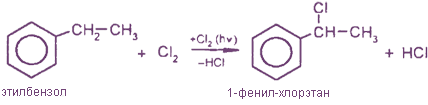
2. Окисление под действием КМnO4, HNO3 и др.

II. Реакции с участием бензольного ядра
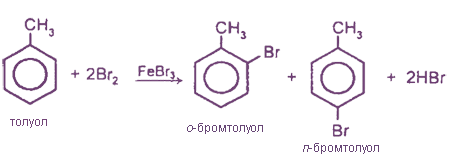
1. Галогенирование
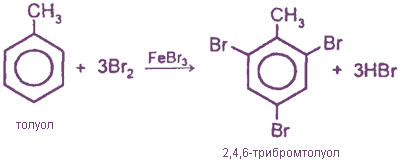
При избытке галогена:
2. Нитрование
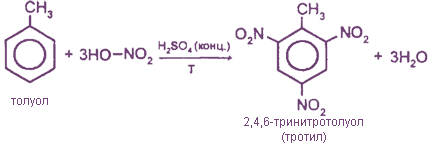
3. Гидрирование
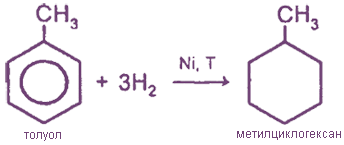
Способы получения бензола
1. Сплавление солей бензойной кислоты с щелочами

2. Дегидрирование циклогексана
См. «Циклоалканы»
3. Дегидроциклизация гексана
См. «Алканы»
4. Тримеризация ацетилена
См. «Алкины»
Способы получения гомологов бензола
1. Алкилирование бензола по Фриделю - Крафтсу
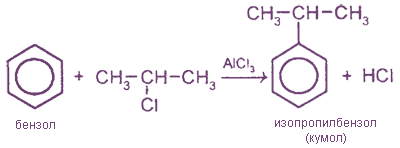
2. Конденсация арилгалогенидов с алкилгалогенидами - реакция Вюрца - Фиттига

3. Ароматизация алканов
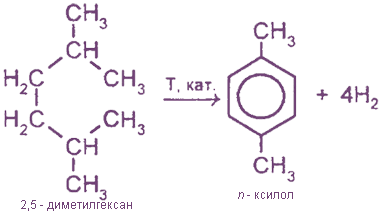
4. Каталитическая дегидрогенизация гомологов циклогексана

Кроме одноядерных ароматических углеводородов, к которым относятся бензол и его гомологи, существуют также многоядерные арены; например: