Анилин
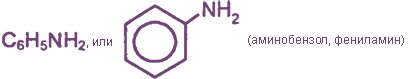
Формула
Электронное строение
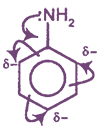
Неподеленная пара электронов атома азота участвует в сопряжении с π-системой бензольного ядра (р,π-сопряжение). Поэтому ее способность к образованию донорно-акцепторной связи ослаблена. В связи с этим основные свойства анилина выражены в значительно меньшей степени, чем у алифатических аминов.
Являясь заместителем 1 рода, аминогруппа повышает электронную плотность в орто- и пара-положениях бензольного ядра (аналогия с фенолом).
Физические свойства
Анилин - бесцветная маслянистая жидкость с характерным запахом, малорастворим в воде, тяжелее воды, ядовит.
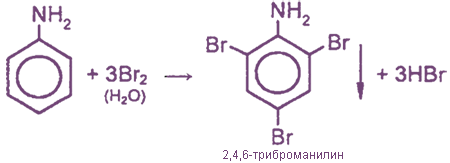
Химические свойства
Взаимодействие с кислотами (образование солей)
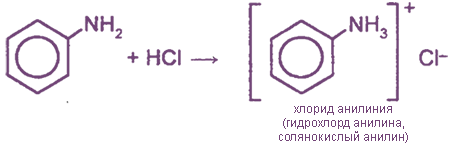
Соли анилина, в отличие от анилина, хорошо растворимы в воде.
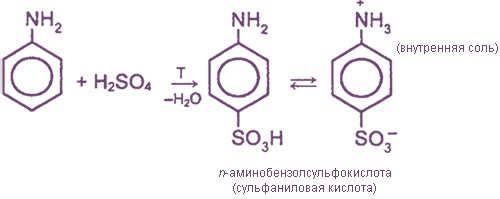
Сульфаниловая кислота является важным промежуточным продуктом в синтезе лекарственных веществ (сульфаниламидных препаратов).
Способы получения
Анилин получают из нитробензола восстановлением нитрогруппы -NO2 в аминогруппу -NH2. Эту реакцию открыл русский химик Н. Н. Зинин
C6H5NO2 + 3(NH4)2S → C6H5NH2 + 6NH3 + 3S + 2H2O
Восстановление можно производить и в кислой среде атомарным водородом, который образуется при взаимодействии металлов с кислотами:
C6H5NO2 + 6Н → C6H5NH2 + 2H2O,
а также газообразным Н2 при высоком давлении в присутствии катализатора:
C6H5NO2 + 3Н2 → C6H5NH2 + 2H2O