Амины
Классификация
- первичные амины R-NH2
(производные углеводородов, в которых атом водорода замещен на аминогруппу -NH2),
- вторичные амины R-NH-R'
- алифатические, например: C2H5-NH2 этиламин



Предельные первичные амины
Общая формула
Номенклатура
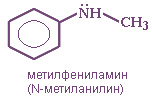
Названия аминов (особенно вторичных и третичных) обычно дают по радикально-функциональной номенклатуре, перечисляя в алфавитном порядке радикалы и добавляя название класса -
CH3-NH2 метанамин (метиламин)
CH3-CH2-NH2 этанамин (этиламин)
Первичные амины часто называют как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы NH2. Аминогруппа при этом рассматривается как заместитель, а ее местоположение указывается цифрой в начале названия. Например:
H2N-CH2-CH2-CH2-CH2-NH2 1,4-диаминобутан.
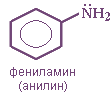
Анилин (фениламин) C6H5NH2 в соответствии с этим способом называется
Гомологический ряд предельных аминов
СН3NH2 - метиламин (первичный амин), (СН3)2NH - диметиламин (вторичный амин), (СН3)3N - триметиламин (третичный амин) и т.д.
Изомерия
- углеродного скелета, начиная с С4H9NH2:
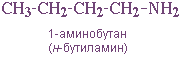
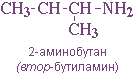
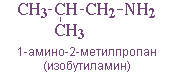
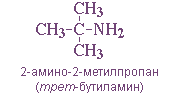
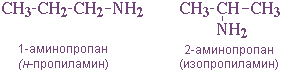
- положения аминогруппы, начиная с С3H7NH2:
- изомерия аминогруппы, связанная с изменением степени замещенности атомов водорода при азоте:

Возможна оптическая изомерия, начиная с С4H9NH2:
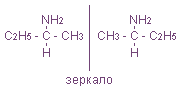
Физические свойства
Низшие предельные амины - газообразные вещества; средние члены гомологического ряда - жидкости; высшие амины - твердые вещества. Метиламин имеет запах аммиака, другие низшие амины - резкий неприятный запах, напоминающий запах селедочного рассола.
Низшие амины хорошо растворимы в воде, с ростом углеводородного радикала растворимость аминов падает. Амины образуются при гниении органических остатков, содержащих белки. Ряд аминов образуется в организмах человека и животных из аминокислот
Химические свойства
Амины, как и аммиак, проявляют ярко выраженные свойства оснований, что обусловлено наличием в молекулах аминов атома азота, имеющего неподеленную пару электронов.

Растворы аминов в воде имеют щелочную реакцию среды.
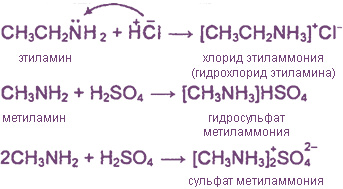
Амины выделяются из их солей при действии щелочей:
[CH3CH2NH3]Cl + NaOH → СН3CH2NH2↑ + NaCl + Н2O
4CH3NH2 + 9O2 → 4СO2 + 10Н2O + 2N2
Под действием HNO2 первичные амины превращаются в спирты с выделением азота:
C2H5NH2 + HNO2 → С2Н5OН + N2↑+ Н2O
Способы получения
СН3Вr + 2NH3 → CH3NH2 + NH4Br
Обычно реакция идет дальше и образуется смесь первичных, вторичных, третичных аминов и соль четвертичного аммониевого основания:
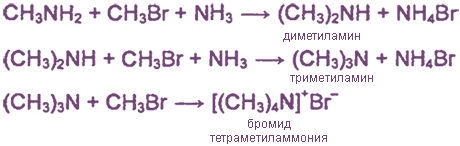

(Практически в этих реакциях образуется смесь первичных, вторичных, третичных аминов и соли четвертичного аммониевого основания.)