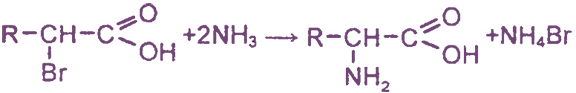Аминокислоты
Классификация
I. По числу функциональных групп
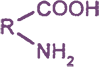
простейший представитель:
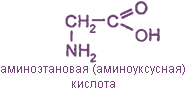

Например:
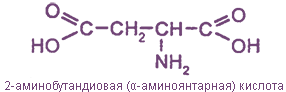
Например:
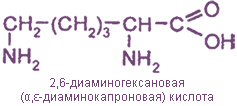
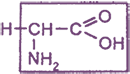
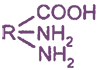
II. По взаимному положению карбоксильной и аминогруппы
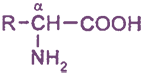
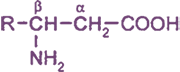
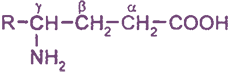
Белки представляют собой природные полимеры, макромолекулы которых построены из большого числа остатков 20 различных α-аминокислот. В биохимии для аминокислот используют, как правило, короткие тривиальные названия и трехбуквенные обозначения.
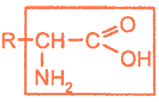
Моноаминомонокарбоновые кислоты
|
Аминоэтановая, или аминоуксусная кислота, или глицин (гликокол) |
Gly (Гли) |
|
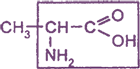
2-аминопропановая, или α-аминопропионовая кислота, или аланин |
Ala (Ала) |
|
2-амино-З-гидроксипропановая, или α-амино-β-гидроксипропионовая кислота, или серин |
Ser (Сер) |
|
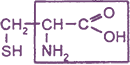
2-амино-З-меркаптопропановая кислота, или β-меркаптоаланин, или цистеин |
Cys (Цис) |
|
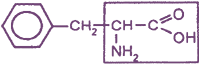
2-амино-З-фенилпропановая кислота, или β-фенилаланин, или фенилаланин |
Phe (Фен) |
|
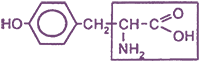
2-амино-3-(4-гидроксифенил)-пропановая кислота, или β-(n-гидроксифенип)-апанин, или тирозин |
Tyr (тир) |
|
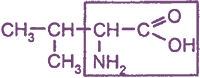
2-амино-З-метилбутановая, или α-аминоизовалериановая кислота, или валин |
Val (Вал) |
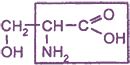
Моноаминодикарбоновые кислоты
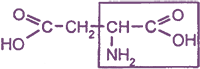 |
(2-)аминобутандиовая, или аминоянтарная кислота, или аспарагиновая кислота |
Asp (Асп) |
|
α-аминоглутаровая кислота, или глутаминовая кислота |
Glu (Глу) |
Диаминомонокарбоновая кислота
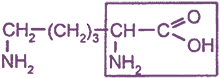 |
2,6-диаминогексановая, или α,ε-диаминокапроновая кислота, или лизин |
Lys (Лиз) |
Классификация природных аминокислот
Физические свойства
Большинство аминокислот - бесцветные кристаллические вещества, хорошо растворимые в воде. Многие аминокислоты имеют сладкий вкус. Температуры плавления разных аминокислот лежат в пределах 230-300°C.
Химические свойства
Аминокислоты являются амфотерными соединениями, что обусловлено наличием в их молекулах функциональных групп кислотного (-СООН) и основного (-NH2) характера.
1. Взаимодействие с основаниями
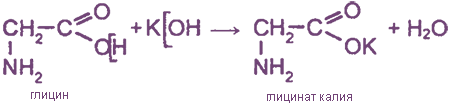
2. Взаимодействие с кислотами
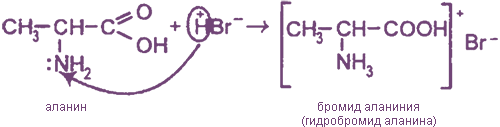
3. Образование внутренних солей (биполярных ионов)
В водных растворах аминокислоты существуют в виде равновесных смесей молекул и биполярных ионов, которые в кислой среде переходят в катионную форму, а в щелочной среде - в анионную форму.
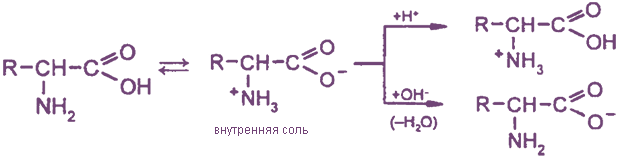
При образовании внутренних солей моноаминомонокарбоновых кислот характер среды не изменяется. Поэтому эти аминокислоты называются нейтральными.
При добавлении кислоты (Н+) карбоксилат-ион протонируется и остается только положительный заряд на группе -NH
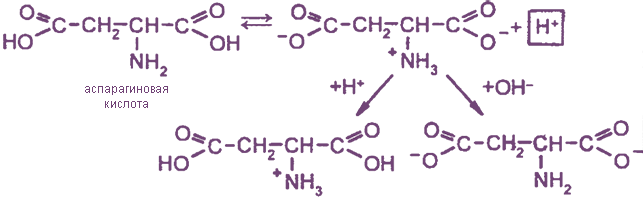
При образовании внутренних солей моноаминодикарбоновых кислот образуется избыток ионов водорода, поэтому водные растворы этих кислот имеют рН < 7. Такие кислоты называются кислыми аминокислотами.
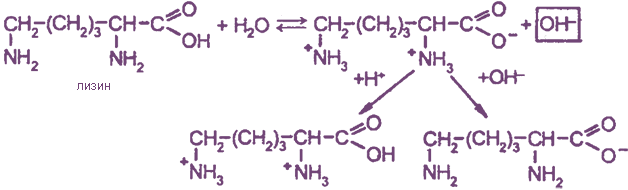
При образовании внутренних солей диаминомонокарбоновых кислот образуется избыток гидроксид-ионов, поэтому их водные растворы имеют рН > 7. Такие аминокислоты называются основными.
4. Образование пептидов
При взаимодействии карбоксильной группы одной молекулы аминокислоты и аминогруппы другой молекулы аминокислоты образуются
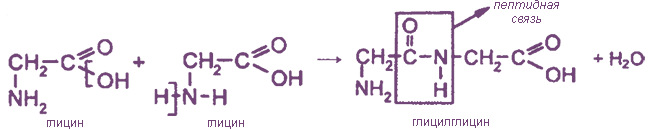
При взаимодействии двух разных аминокислот образуется смесь четырех дипептидов; например:
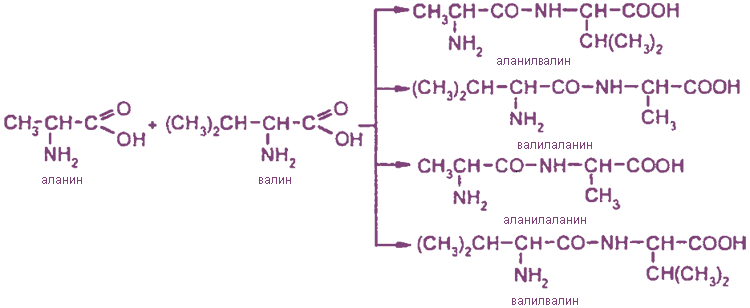
Дипептид, присоединяя еще одну молекулу аминокислоты, может образовать
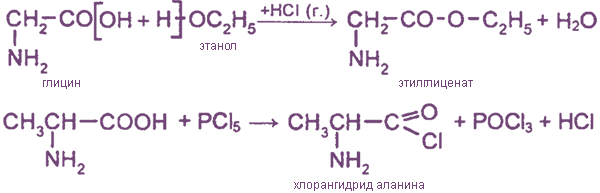
5. Образование производных по карбоксильной группе
Как и карбоновые кислоты, аминокислоты могут образовывать сложные эфиры, хлорангидриды и др. Например:
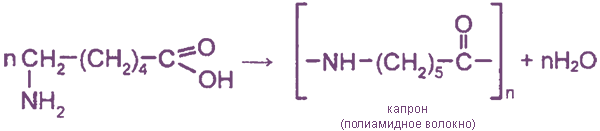
Способы получения