Непредельные углеводороды. Алкины
Строение алкинов
Первым и основным представителем гомологического ряда алкинов является ацетилен (этин) С2Н2. Строение его молекулы выражается формулами:
структурная формула
Н - С ≡ С - Н
или
электронная формула
Н:С:::С:Н
По названию первого представителя этого ряда - ацетилена - эти непредельные углеводороды называют
В алкинах атомы углерода находятся в третьем валентном состоянии (sp-гибридизация). В этом случае между углеродными атомами возникает тройная связь, состоящая из одной σ - и двух π -связей. Длина тройной связи равна 0,12 нм, а энергия ее образования составляет 830 кДж/моль.
Номенклатура
Простейшим алкином является этин (ацетилен С2Н2). По номенклатуре IUPAC названия алкинов образуются от названий соответствующих алканов заменой суффикса
Углеводородные радикалы, образованные от алкинов имеют суффикс
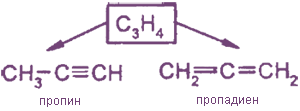
Гомологический ряд
Этин:C2H2 Пропин: C3H4 Бутин: C4H6 Пентин: C5H8 Гексин: C6H10 Гептин: C7H12 Октин: C8H14 Нонин: C9H16 Децин: C10H18
Изомерия
Изомерия алкиновых углеводородов (как и алкеновых) определяется строением цепи и положением в ней кратной (тройной) связи:
1. Изомерия углеродного скелета
(такая же как у алканов и алкенов)
2. Изомерия положения кратной связи
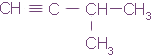 З-метилбутин-1
З-метилбутин-1
Н - С ≡ С - СН2 - СН2 - СН3 пентин-1
Н3С - С ≡ С - СН2 - СН3 пентин-2
3. Межклассовая изомерия:
Алкины являются изомерами с алкадиенами.
Физические свойства алкинов
Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до С4) - газы без цвета и запаха, имеющие более высокие температуры кипения, чем аналоги в алкенах. Алкины плохо растворимы в воде, лучше - в органических растворителях.
Плохо растворимы в воде.
Химические свойства
Химические свойства алкинов определяются тройной связью, особенностями ее строения. Алкины способны вступать в реакции присоединения, замещения, полимеризации и окисления.
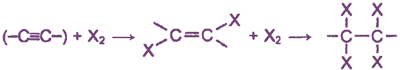
Реакции присоединения
Будучи непредельными соединениями, алкины вступают в первую очередь в реакции присоединения. Эти реакции протекают ступенчато: с присоединением одной молекулы реагента тройная связь вначале переходит в двойную, а затем, по мере дальнейшего присоединения, - в одинарную.
Казалось бы, алкины, обладая двумя π-связями, гораздо активнее должны вступать в реакции электрофильного присоединения. Но это не совсем так. Углеродные атомы в молекулах алкинов расположены ближе друг к другу, чем в алкенах, и обладают большей электроотрицательностью. Это связано с тем, что электроотрицательность атома углерода зависит от его валентного состояния. Поэтому p-электроны, находясь ближе к ядрам углерода, проявляют несколько меньшую активность в реакциях электрофильного присоединения. Кроме того, сказывается, близость положительно заряженных ядер атомов, способных отталкивать приближающиеся электрофильные реагенты (катионы). В то же время алкины могут вступать в реакции нуклеофильиого присоединения (со спиртами, аммиаком и др.).
1. Гидрирование
Реакция протекает в тех же условиях, что и в случае алкенов (катализаторы Pt, Pd, Ni). При восстановлении алкинов вначале образуются алкены, а затем - алканы:
HC ≡ CH + H2 → H2C = CH2 + H2 → H3C—CH3
ацетилен → этилен → этан
2. Галогенирование
Эта реакция протекает с меньшей скоростью, чем в ряду этиленовых углеводородов. Реакция также проходит ступенчато:
HC ≡ CH + Br2 → CHBr = CHBr + Br2 → CHBr2 - CHBr2
ацетилен → 1,2-дибромэтан → 1,1,2,2-тетрабромэтан
Качественная реакция; бромная вода обесцвечивается.
3. Гидрогалогенирование
Реакции присоединения галогеноводородов, как и галогенов, идут в основном по механизму электрофильного присоединения:
HC ≡ CH + HCl → H2C = CHCl → H3C - CHCl2
ацетилен → хлорэтен → 1,1-дихлорэтан
Вторая молекула галогеноводорода присоединяется в соответствии с правилом Марковникова.
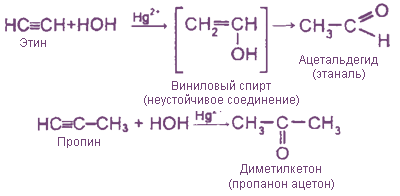
4. Гидратация (реакция М.Г.Кучерова,. 1881)
Образуется ацетальдегид в случае С2Н2 и кетоны - в случае гомологов ацетилена.
Катализатор - соль ртути: HgSO4
5. Присоединение синильной кислоты
HC ≡ CH + HCN кат.→ H2C = CH - CN (акрилонитрил)
Акрилонитрил - ценный продукт. Он используется в качестве мономера для получения синтетического волокна - нитрон.
6. Присоединение спирта
В результате этой реакции образуются простые виниловые эфиры (реакция А. Е.Фаворского):
HC ≡ CH + HO - C2H5 KOH→ H2C = CH - O - C2H5 (этилвиниловый эфир)
Присоединение спиртов в присутствии алкоголятов - типичная реакция нуклеофильного присоединения.
Реакции замещения
Водородные атомы в ацетилене способны замещаться на металлы (реакция металлирования). В результате образуются металлические производные ацетилена - ацетилениды. Такую способность ацетилена можно объяснить следующим образом. Углеродные атомы ацетилена, находясь в состоянии sp-гибридизации, отличаются, как известно, повышенной электроотрицательностью (по сравнению с углеродами в других гибридных состояниях). Поэтому электронная плотность связи С-H несколько смещена в сторону углерода и атом водорода приобретает некоторую подвижность:
d+ d- d- d+
H→C≡C←H
Образуются нерастворимые соли - ацетилениды. Возможны только для алкинов, содержащих этинильную группу -С=СН (т. н. терминальные алкины).
HC ≡ CH + 2CuCl → Cu - C ≡ C - Cu↓ + HCl
этин → ацетиленид меди(I) двузамещенный
CH3 - C ≡ CH + CuCl → CH3 - C ≡ C- Cu↓ + HCl
пропин → метилацетиленид меди (I)
Образование темно-красных осадков ацетиленидов меди - качественная реакция на этинильную группу, позволяющая отличить терминальные алкины от других непредельных углеводородов.


С ацетиленидами в сухом виде следует обращаться очень осторожно: они крайне взрывоопасны.
Реакция изомеризации
Ацетиленовые углеводороды, как алканы и алкены, способны к изомеризации с перемещением тройной связи:
Н3С - СН2- С ≡ СН Na(спирт р-р)→ Н3С - С ≡ С - СН3
бутин-1 → бутин-2
Реакции ди-, три- и полимеризации
Из винилацетилена присоединением HCl получают хлоропрен, при полимеризации которого образуется хлоропреновый каучук:


Циклотримеризация
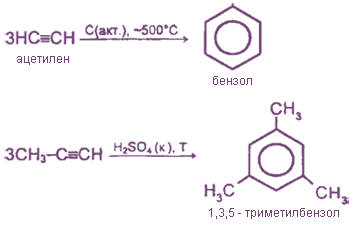
Полимеризация для алкинов малохарактерна.
Реакции окисления
1. Неполное окисление под действием КМnО4 (образуются карбоновые кислоты)
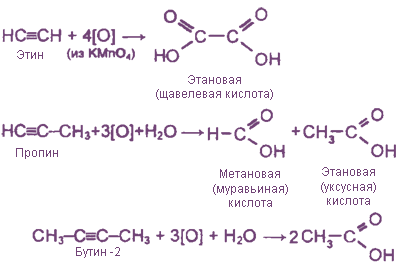
2. Полное окисление под действием КМnО4
Ацетилены легко окисляются. При этом происходит разрыв молекулы по месту тройной связи. Если ацетилен пропускать через окислитель (водный раствор перманганата калия), то раствор быстро обесцвечивается.
3НC ≡ СН + 10KMnO4 + 2H2O → 6CO2 + 10КОН + 10MnO2
3. Горение
Ацетилен горит коптящим пламенем.
При полном сгорании ацетилена на воздухе образуются два продукта оксид углерода (IV) и вода:
2НС ≡ СН + 5O2 → 4СO2 + 2Н2O
При неполном сгорании образуется углерод (сажа):
НС ≡ СН + O2 → С + СО + Н2О
Способы получения
Ацетилен
Ацетилен в промышленности и в лаборатории можно получать следующими способами:
1. Карбидный способ
Разложением водой карбида кальция СаС2, который получают спеканием негашеной извести СаО с коксом:
СаО + 3C 2500°C→ CaC2 + CO
СаС2 + 2Н2O → НС ≡ СН + Са(ОН)2
2. Термическим разложением (крекинг) природного газа — метана:
2СН4 1500°C→ НС ≡ СН + 3Н2
или этана:
С2Н6 1200°C→ НС ≡ СН + 2Н2
Общие для С2Н2 и его гомологов
Дегидрогалогенирование дигалогеналканов при действии избытка спиртового раствора щелочи
Из дигапогеналканов, содержащих атомы галогена у двух соседних атомов углерода, например:
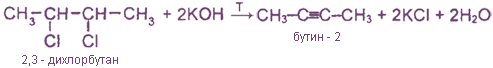
Из дигалогеналканов, содержащих два атома галогена у одного атома углерода, например:
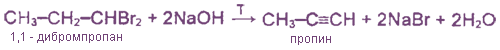
Качественные реакции
Качественной реакцией на алкины с концевой тройной связью является взаимодействие с аммиакатом серебра или меди.
Для подтверждения наличия тройной связи в соединении используют методы спектроскопии.
Применение
Из всех ацетиленовых углеводородов серьёзное промышленное значение имеет только ацетилен, который является важнейшим химическим сырьём. Его применяют:
- для сварки и резки металлов;

- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды;
- в производстве взрывчатых веществ
Ацетилениды тяжелых металлов обладают значительной химической неустойчивостью, при незначительных внешних воздействиях (удар, трение) разлагаются со взрывом. Наиболее известны как инициирующие взрывчатые вещества (ВВ) ацетилениды серебра Ag2C2 и меди Cu2C2. Также следует отметить сильнейшие взрывчатые способности ацетеленида ртути. Очень сильными взрывчатыми свойствами обладает ацетеленид золота.
- для получения уксусной кислоты, этилового спирта;
- для получения растворителей - индивидуальное химическое соединение или их смесь, способная растворять различные вещества, то есть образовывать с ними однородные системы переменного состава двух или большего числа компонентов;

- для получения пластических масс - органические материалы, основой которых являются синтетические или природные высокомолекулярные соединения (полимеры). Исключительно широкое применение получили пластмассы на основе синтетических полимеров.
Название «пластмассы» означает, что эти материалы под действием нагревания и давления способны формироваться и сохранять после охлаждения или отвердения заданную форму. Процесс формования сопровождается переходом пластически деформируемого (вязкотекучего) состояния в стеклообразное состояние.

- для получения каучука - натуральные или синтетические эластомеры, характеризующиеся эластичностью, водонепроницаемостью и электроизоляционными свойствами, из которых путём вулканизации получают резины и эбониты.

Нахождение в природе и физиологическая роль алкинов
В природе алкины практически не встречаются. В некоторых видах грибов Basidiomycetes были обнаружены в крайне малом количестве соединения содержащие полиацетиленовые структуры.
Ацетилен обнаружен в атмосфере Урана, Юпитера и Сатурна.
Алкины обладают слабым наркозным действием. Жидкие алкины вызывают судороги.