Непредельные углеводороды. Алкадиены. Каучуки
Классификация алкадиенов
Диены с изолированными связями
Если двойные связи разделены в углеродной цепи двумя или более одинарными связями (например, пентадиен-1,4), то такие двойные связи называются
CH2 = CH - CH2 - CH = CH2 пентадиен-1,4
CH2 = CH - CH2 - CH2- CH = CH2 гексадиен-1,5
Диены с сопряженными связями
Если двойные связи разделены в цепи только одной одинарной s-связью, то их называют
СН2 = СН - СН = СН2 бутадиен-1,3 (дивинил)
![]() 2-метилбутадиен-1,3 (изопрен)
2-метилбутадиен-1,3 (изопрен)
Диены с кумулированными связями
Существуют также диены с системой С = С = С, называемые
Первый член гомологического ряда - пропадиен (аллен) СН2 = С = СН2 : бесцветный газ с tnл = -136,2 °С и tкип = -34,5 °С.
H2С = С = СH - СH2 - СH3 пентадиен-1,2
Строение сопряженных алкадиенов
Далее рассмотрим только сопряженные диены, имеющие большое практическое значение.
В сопряженных диенах р-электронные облака двойных связей перекрываются между собой и образуют единое π-электронное облако. В сопряженной системе p-электроны уже не принадлежат определенным связям, они делокализованы по всем атомам, поэтому структуру диенов можно изобразить следующим образом (на примере бутадиена):

Пунктирные линии показывают область делокализации электронов и обозначают промежуточный порядок связи между С - С и С = С. Цепь сопряжения может включать большое число двойных связей. Чем она длиннее, тем больше делокализация p-электронов и тем устойчивее молекула.
Изомерия и номенклатура
Для алкадиенов характерны те же
1) изомерия углеродного скелета;
2) изомерия положения двойных связей;
3) цис-транс-изомерия.
Номенклатура
Главную цепь в диенах выбирают так, чтобы она содержала обе двойные связи, и нумеруют с того конца, при котором сумма номеров положений двойных связей минимальна. В названии соответствующего алкана окончание
Физические свойства
Бутадиен-1,3 - легко сжижающийся газ с неприятным запахом. Изопрен - жидкость с tкип 34 °С.
Получение
Бутадиен-1,3
1. Дегидрирование и дегидратация этанола - реакция Лебедева
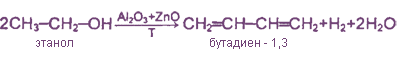
2. Дегидрирование н. бутана
Изопрен
Дегидрирование 2-метилбутана
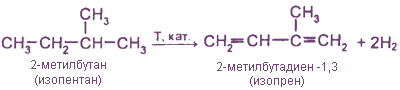
Хлоропрен (2-хлорбутадиен-1,3)
Димеризация ацетилена и гидрохлорирование образующегося винилацетилена
1-я стадия:
2-я стадия:

Химические свойства
Для алкадиенов характерны обычные реакции электрофильного присоединения АE, свойственные алкенам. Наибольшее значение имеют диены с сопряженными связями, так как они являются сырьем для получения каучуков. В химическом поведении этих диенов есть особенности, обусловленные наличием в их молекулах сопряжения. Особенность сопряженных диенов состоит в том, что две двойные связи в их молекулах функционируют как единое целое, поэтому реакции присоединения могут протекать в двух направлениях:
1. Реакции присоединения
Так, присоединение брома к бутадиену может привести к двум продуктам:
1,2-присоединение
СН2 = СН - СН = СН2 + Вr2 → СН2 = СН - СНВr - СН2Вr
или
1,4-присоединение
СН2 = СН - СН = СН2 + Вr2 → ВrСН2 - СН = СН - СН2Вr
Подбор реагентов и условий реакций позволяет направлять присоединение по любому из двух направлений.
2. Реакции полимеризации (образуются синтетические каучуки)
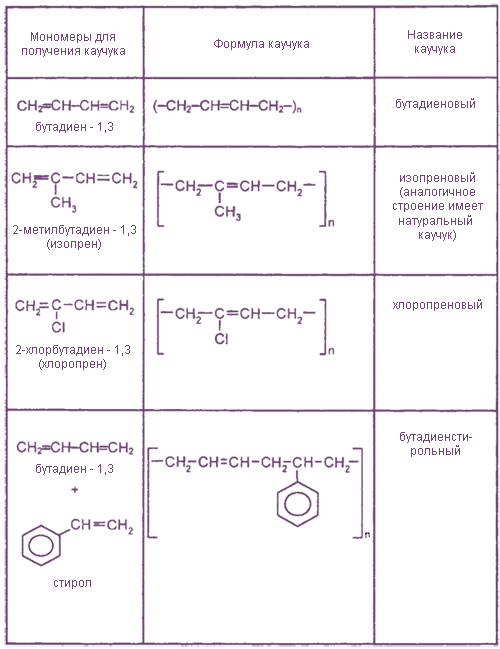
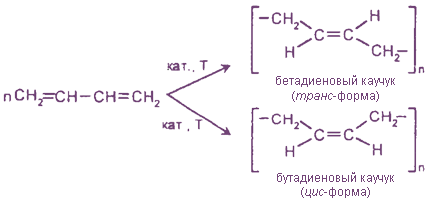
2. Важнейшее свойство диенов - их способность к полимеризации, которая используется для получения синтетических каучуков. При полимеризации бутадиена-1,3, которая протекает как 1,4-присоединение, получают бутадиеновый каучук:
nСН2 = СН - СН = СН2 → (-СН2 - СН = СН - СН2-)n
Использование металлоорганических катализаторов в этой реакции позволяет получить каучук с регулярным строением, в котором все звенья цепи имеют цис-конфигурацию. Аналогичная реакция с изопреном дает синтетический изопреновый каучук, который по строению и свойствам близок к природному каучуку:
nСН2 = С(СН3) - СН = СН2 → (-СН2 - С(СН3) = СН - СН2-)n
Применение
Основная область применения алкадиенов - синтез каучуков.
Каучуки
Диеновые углеводороды полимеризуются и сополимеризуются с различными виниловыми мономерами с образованием каучуков, из которых в процессе вулканизации получают различные сорта резин.