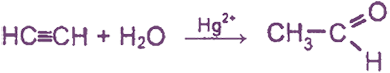Альдегиды
Общая формула альдегидов:
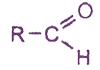
(для простейшего альдегида R=H)
Классификация альдегидов
По строению углеводородного радикала:
- предельные; например:
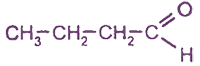
- непредельные; например:

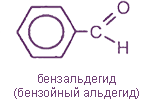
- ароматические; например:
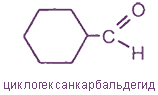
- алициклические; например:
Общая формула предельных альдегидов
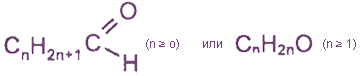
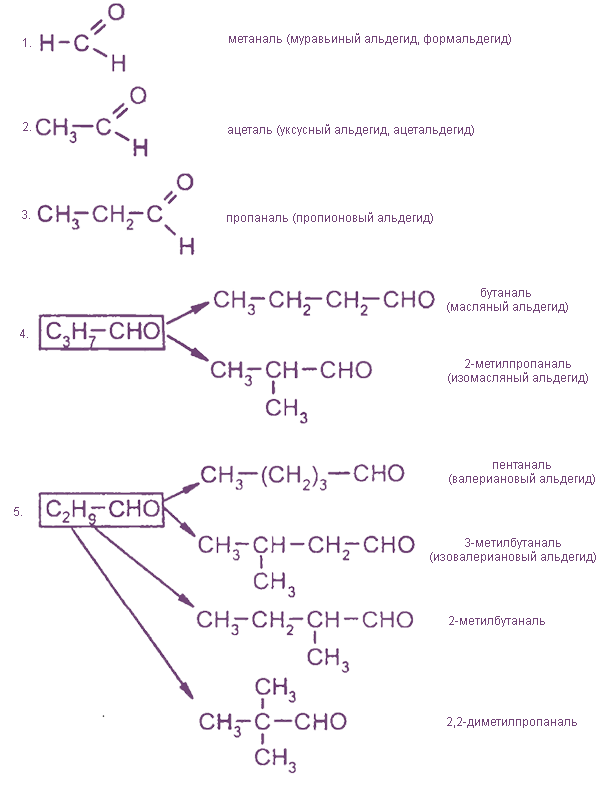
Гомологический ряд, изомерия, номенклатура
Альдегиды изомерны другому классу соединений - кетонам
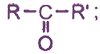
например:
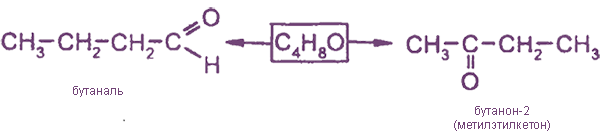
Альдегиды и кетоны содержат карбонильную группу ˃C=O, поэтому называются
Электронное строение молекул альдегидов
Атом углерода альдегидной группы находится в состоянии sp2-гибридизации, поэтому все σ-связи в этой группе располагаются в одной плоскости. Облака р-электронов, образующих π-связь, перпендикулярны этой плоскости и легко смещаются к более электроотрицательному атому кислорода. Поэтому двойная связь C=O (в отличие от двойной связи C=C в алкенах) сильно поляризована.
Физические свойства

Химические свойства
Альдегиды - реакционноспособные соединения, вступающие в многочисленные реакции. Наиболее характерны для альдегидов:
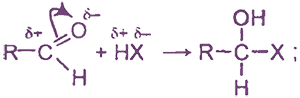
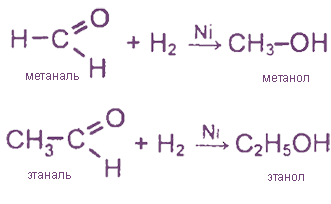
I. Реакции присоединения
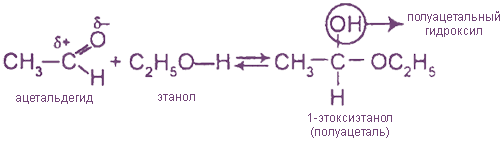
В избытке спирта в присутствии HCl полуацетали превращаются в ацетали:
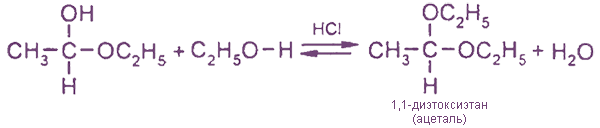
II. Реакции окисления
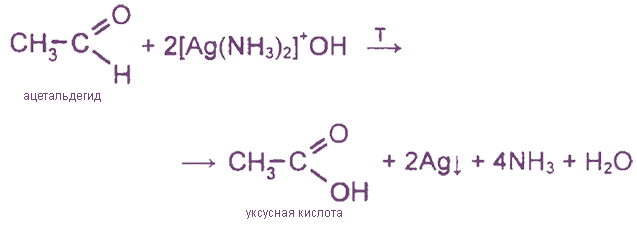
Упрощённо:
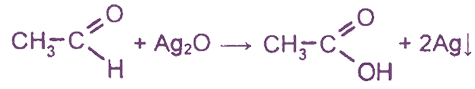
Эта реакция является
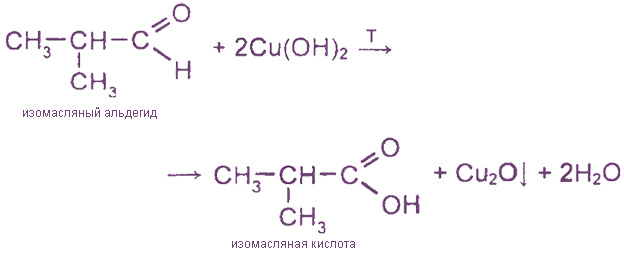
Эта реакция также является
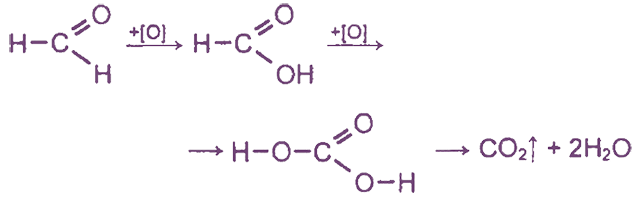
Формальдегид окисляется различными O-содержащими окислителями сначала до муравьиной кислоты и далее - до Н2СO3(СO2 + Н2O):
III. Реакции ди-, три- и полимеризации
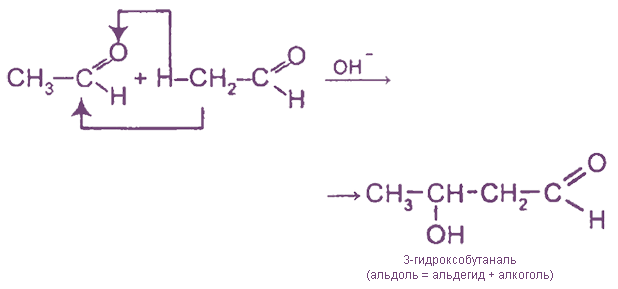
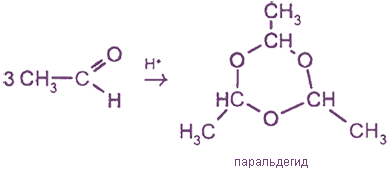
3. Полимеризация формальдегида
При длительном хранении формалина (40%-ный водный раствор формальдегида) в нем происходит полимеризация с образованием белого осадка параформа:
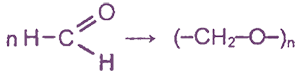
IV. Реакция поликонденсации формальдегида с фенолом
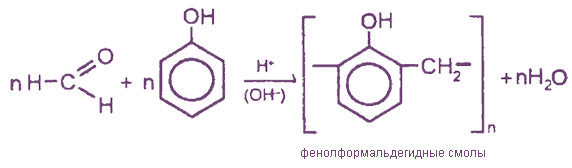
V. Превращение формальдегида в углеводы
VI. Взаимодействие формальдегида с аммиаком
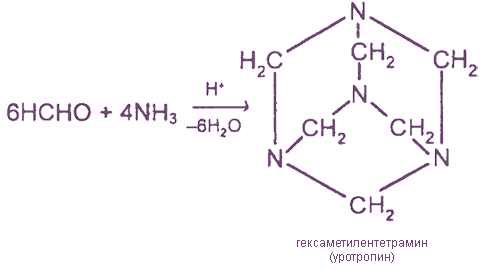
Способы получения
1. Окисление алкенов

2. Каталитическое окисление первичных спиртов

3. Окисление первичных спиртов различными окислителями (КМnО4, K2Cr2О7 и др.)
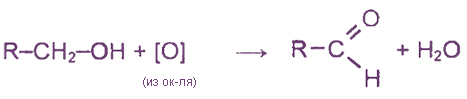
4. Каталитическое дегидрирование первичных спиртов
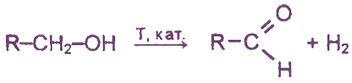
5. Щелочной гидролиз дигалогеналканов, содержащих атомы галогена у первичного атома углерода.
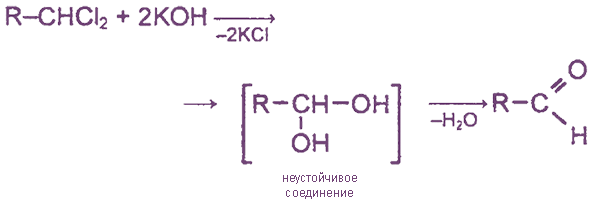
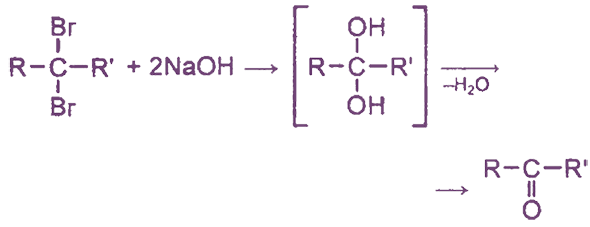
При гидролизе дигалогеналканов, содержащих атомы галогена у вторичного атома углерода, образуются кетоны:
Специфические способы получения формальдегида и ацетальдегида
1. Каталитическое окисление метана

2. Гидратация ацетилена (реакция Кучерова)