Водород
1H 1s1
Изотопы:
11Н - протий - 99.985 %
12Н - дейтерий (Д) - 0.015 %,
13Н - тритий (Т) - радиоакт.
Аr 1,008
ЭО 2,1
На Земле атомы Н находятся в составе молекул Н2O, углеводородов СХНУ и других органических веществ.
Из каждых 100 атомов, распространенных на Земле, 16 - атомы водорода. В ПСЭ водород занимает уникальное положение - его располагают в двух главных подгруппах (I и VII групп).

По электронной конфигурации он формально относится к семейству s-элементов и имеет сходство со щел. Me:
- степень окисления +1 (в большинстве соединений);
- восстановительные свойства (Н° -1e- → Н+).
В соединениях с металлами (гидридах МеНх) водород имеет степень окисления -1 и проявляет свойства солеобразующего аниона Н1 (подобно галогенам). Кроме того, в свободном состоянии водород представляет собой газ, состоящий из двухатомных молекул Н2, что коренным образом отличает его от щел. Me и сближает с Hal2.
Физические свойства молекулярного
При об. Т Н2 - очень легкий бесцв. газ, без запаха, плохо растворимый в воде. Хорошо растворяется в твердых и расплавленных металлах, особенно Pt, Pd, Ni.
Способы получения
Основными видами сырья для промышленного производства Н2 являются газообразные, жидкие и твердые горючие ископаемые, а также вода.
а) Конверсия метана с водяным паром:
CH4 + H2O = СО + ЗН2
б) Газификация твердого топлива:
C + H2O = СО + Н2
(уголь) «водяной газ»
в) Электролитическое разложение воды в присутствии щелочей:
2Н2O = 2Н2 + O2
а) Взаимодействие активных металлов с разбавленными растворами HCl или H2SO4, например:
Zn + 2HCl = ZnCl2 + H2
б) Взаимодействие щел. и щел.-зем. металлов с водой, например:
Са + 2Н2O = Са(ОН)2 + Н2
в) Взаимодействие Al, Zn, Si с водными растворами щелочей:
2Al + 2NaOH + 6Н2O = 2Na [Al(OH)4] + ЗН2
Si + 2NaOH + Н2O = Na2SiO3 + 2Н2
г) Электролиз разбавленных растворов хлоридов щел. металлов, например:
2NaCl + 2Н2O = Н2 + Cl2 + 2NaOH
д) Действие воды на гидриды металлов:
СаН2 + 2Н2O = 2H2 + Са(ОН)2
Химические свойства
Исключительно высокая прочность связи в молекуле водорода обусловливает высокие энергии активации химических реакций с его участием, поэтому при обычных условиях молекулярный водород малоактивен. Для инициирования реакций требуется значительное нагревание или другие способы активации, например, катализ. При этих условиях водород реагирует, в большинстве случаев проявляя восстановительные свойства:
Н2 - 2e- = 2Н+
2Н2 + O2 = 2Н2O
При об. Т скорость реакции близка к нулю, но если поджечь водород, то он взаимодействует с кислородом воздуха в режиме горения.
Водород - горючий газ; смесь двух объемов Н2 с 1 объемом O2 -
Взаимодействие:
а) с фтором (при об. Т) Н2 + F2 = 2HF
б) с хлором (при УФ-облучении, при освещении) Н2 + Cl2 = 2HCl
в) с серой (при t > 600°С, реакция обратима) Н2 + S = H2S
г) с азотом и углеродом водород реагирует в жестких условиях; реакции сильно обратимы, для их смещения вправо необходимо высокое давление.
ЗН2+ N2 = 2NH3
Н2 + CuO = Сu + Н2O
2Н2 + SO2 = S + 2Н2O
3Н2 + WO3 = W + 3Н2O
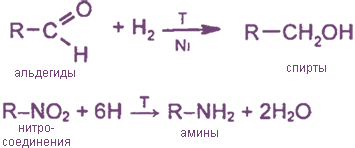
Н2 + 2e- → 2Н
При взаимодействии Н2 с расплавленными металлами под давлением образуются гидриды металлов, например:
Н2 + 2Na = 2Na+H-
Н2 + Ca = Ca+2H-2
Характеристика гидридов металлов МеНх
Гидриды щел. и щел.-зем. Me - кристаллические ионные соединения, в расплавленном состоянии проводят электрический ток. Обладают высокой химической активностью, сильные восстановители. Взаимодействуют бурно с 02 воздуха, разлагают воду, восстанавливают металлы из оксидов, реагируют даже с азотом.
Примеры реакций:
CaH2 + O2 = CaO + H2O
NaH + H2O = NaOH + H2↑
3CaH2 + N2 = Ca3N2 + 3H2↑
При электролизе расплавов гидридов МеНх водород выделяется на аноде!