Углерод и его соединения
Элемент С находится во 2-м периоде, в главной подгруппе IV группы периодической системы элементов.
Углерод
Характеристика элемента
6С 1s22s22p2
Аr = 12,011
Изотопы: 12С (98,892 %); 13С (1,108%); 14С (радиоактивный)
ЭО - 2,5
Кларк в земной коре 0,48 % по массе. Формы нахождения:
в свободном виде (каменный уголь, алмазы);
в составе карбонатов (СаСO3, МgСO3 и др.);
в составе горючих ископаемых (уголь, нефть, газ);
в виде СO2 - в атмосфере (0,03 % по объему);
в Мировом океане - в виде анионов НСO3-;
в составе живой материи (-18 % углерода).
Химия соединений углерода - это, в основном, органическая химия. В курсе неорганической химии изучаются следующие С-содержащие вещества: свободный углерод, оксиды (СО и СO2), угольная кислота, карбонаты и гидрокарбонаты.
Свободный углерод. Аллотропия.
В свободном состоянии углерод образует 3 аллотропные модификации: алмаз, графит и искусственно получаемый карбин. Эти видоизменения углерода различаются кристаллохимическим строением и физическими характеристиками.
Алмаз
В кристалле алмаза каждый атом углерода связан прочными ковалентными связями с четырьмя другими, размещенными вокруг него на одинаковых расстояниях.
Все атомы углерода находятся в состоянии sp3-гибридизации. Атомная кристаллическая решетка алмаза имеет тетраэдрическое строение.
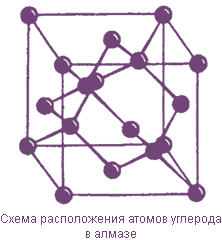
Алмаз - бесцветное, прозрачное, сильно преломляющее свет вещество. Отличается самой большой твердостью среди всех известных веществ. Алмаз хрупкий, тугоплавкий, плохо проводит тепло и электрический ток. Небольшие расстояния между соседними атомами углерода (0,154 нм) обусловливают довольно большую плотность алмаза (3,5 г/см3).
Графит
В кристаллической решетке графита каждый атом углерода находится в состоянии sp2-гибридизации и образует три прочные ковалентные связи с атомами углерода, расположенными в том же слое. В образовании этих связей участвуют по три электрона каждого атома, углерода, а четвертые валентные электроны образуют л-связи и являются относительно свободными (подвижными). Они обусловливают электро- и теплопроводность графита.
Длина ковалентной связи между соседними атомами углерода в одной плоскости равна 0,152 нм, а расстояние между атомами С в различных слоях больше в 2,5 раза, поэтому связи между ними слабые.
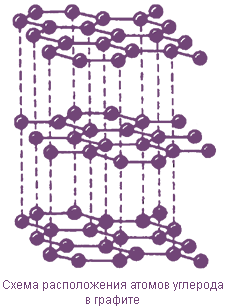
Графит - непрозрачное, мягкое, жирное на ощупь вещество серо-черного цвета с металлическим блеском; хорошо проводит тепло и электрический ток. Графит имеет меньшую плотность по сравнению с алмазом, легко расщепляется на тонкие чешуйки.
Разупорядоченная структура мелкокристаллического графита лежит в основе строения различных форм аморфного углерода, важнейшими из которых являются кокс, бурые и каменные угли, сажа, активированный (активный) уголь.
Карбин
Эту аллотропную модификацию углерода получают каталитическим окислением (дегидрополиконденсацией) ацетилена. Карбин - цепочечный полимер, имеющий две формы:
..-С=С-С=С-... и ...=С=С=С=
Карбин обладает полупроводниковыми свойствами.
Химические свойства углерода
При обычной температуре обе модификации углерода (алмаз и графит) химически инертны. Мелкокристаллические формы графита - кокс, сажа, активированный уголь - более реакционноспособны, но, как правило, после их предварительного нагревания до высокой температуры.
С - активный восстановитель:
1. Взаимодействие с кислородом
С + O2 = СO2 + 393,5 кДж (в избытке O2)
2С + O2 = 2СО + 221 кДж (при недостатке O2)
Сжигание угля - один из важнейших источников энергии.
2. Взаимодействие с фтором и серой.
С + 2F2 = CF4 тетрафторид углерода
С + 2S = CS2 сероуглерод
3. Кокс - один из важнейших восстановителей, используемых в промышленности. В металлургии с его помощью получают металлы из оксидов, например:
ЗС + Fe2O3 = 2Fe + ЗСО
С + ZnO = Zn + СО
4. При взаимодействии углерода с оксидами щелочных и щелочноземельных металлов восстановленный металл, соединяясь с углеродом, образует карбид. Например: ЗС + СаО = СаС2 + СО карбид кальция
5. Кокс применяется также для получения кремния:
2С + SiO2 = Si + 2СО
6. При избытке кокса образуется карбид кремния (карборунд) SiC.
Получение «водяного газа» (газификация твердого топлива)
Пропусканием водяного пара через раскаленный уголь получают горючую смесь СО и Н2, называемую водяным газом:
С + Н2О = СО + Н2
7. Реакции с окисляющими кислотами.
Активированный или древесный уголь при нагревании восстанавливает анионы NO3- и SO42- из концентрированных кислот:
С + 4HNO3 = СO2 + 4NO2↑ + 2Н2О
С + 2H2SO4 = СO2↑ + 2SO2↑ + 2Н2О
8. Реакции с расплавленными нитратами щелочных металлов
В расплавах KNO3 и NaNO3 измельченный уголь интенсивно сгорает с образованием ослепительного пламени:
5С + 4KNO3 = 2К2СO3 + ЗСO2↑ + 2N2↑
С - малоактивный окислитель:
1. Образование солеобразных карбидов с активными металлами.
Значительное ослабление неметаллических свойств у углерода выражается в том, что функции его как окислителя проявляются в гораздо меньшей степени, чем восстановительные функции.
2. Только в реакциях с активными металлами атомы углерода переходят в отрицательно заряженные ионы С-4 и (С=С)2- , образуя солеобразные карбиды:
ЗС + 4Al = Аl4С3 карбид алюминия
2С + Са = СаС2 карбид кальция
3. Карбиды ионного типа - очень нестойкие соединения, они легко разлагаются под действием кислот и воды, что свидетельствует о неустойчивости отрицательно заряженных анионов углерода:
Аl4С3 + 12Н2О = ЗСН4 + 4Аl(ОН)3
СаС2 + 2Н2О = С2Н2↑ + Са(ОН)2
4. Образование ковалентных соединений с металлами
В расплавах смесей углерода с переходными металлами образуются карбиды преимущественно с ковалентный типом связи. Молекулы их имеют переменный состав, а вещества в целом близки к сплавам. Такие карбиды отличаются высокой устойчивостью, они химически инертны по отношению к воде, кислотам, щелочам и многим другим реагентам.
5. Взаимодействие с водородом
При высоких Т и Р, в присутствии никелевого катализатора, углерод соединяется с водородом:
С + 2НН2 → СНН4
Реакция очень обратима и не имеет практического значения.