Главная подгруппа VII группы
Элементы, входящие в VII группу периодической системы, делятся на 2 подгруппы:
Общая характеристика подгруппы
9F 1s22s22p5
17Cl [Ne] 3s23p5
35Br [Ar] 3d104s24p5
53I [Kr] 4d105s25p5
85At [Xe] 4f145d106s26p5
В подгруппу галогенов входят фтор, хлор, бром, иод и астат (астат - радиоактивный элемент, изучен мало). Это р-элементы группы периодической системы Д.И. Менделеева. На внешнем энергетическом уровне их атомы имеют по 7 электронов ns2np5. Этим объясняется общность их свойств.
Свойства элементов подгруппы галогенов
Свойства |
F |
Cl |
Br |
I |
At |
1. Порядковый номер |
9 |
17 |
35 |
53 |
85 |
2. Валентные электроны |
2s22p5 |
3s23p5 |
4s24p5 |
5s25p5 |
6s26p5 |
3. Энергия ионизации атома, эВ |
17,42 |
12,97 |
11,84 |
10,45 |
9,2 |
4. Относительная электроотрицательность |
4,1 |
2,83 |
2,74 |
2,21 |
1,90 |
5. Степень окисления в соединениях |
-1 |
-1, +1, +3, +5, +7 |
-1, +1, +3, +5, +7 |
-1, +1, +3, +5, +7 |
-1, +1, +3, +5, +7 |
6. Радиус атома, нм |
0.064 |
0,099 |
0,114 |
0,133 |
- |
Они легко присоединяют по одному электрону, проявляя степень окисления -1. Такую степень окисления галогены имеют в соединениях с водородом и металлами.
Однако атомы галогенов, кроме фтора, могут проявлять и положительные степени окисления : +1, +3, +5, +7. Возможные значения степеней окисления объясняются электронным строением, которое у атомов фтора можно представить схемой

Будучи наиболее электроотрицательным элементом, фтор может только принимать один электрон на 2р-подуровень. У него один неспаренный электрон, поэтому фтор бывает только одновалентным, а степень окисления всегда -1.
Электронное строение атома хлора выражается схемой:
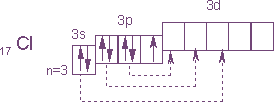
У атома хлора один неспаренный электрон на 3р-подуровне и обычном (невозбужденном) состоянии хлор одновалентен. Но поскольку хлор находится в третьем периоде, то у него имеется еще пять орбиталей 3 -подуровня, в которых могут разместиться 10 электронов.
В возбужденном состоянии атома хлора электроны переходят с 3p - и 3s-подуровней на 3d-подуровень (на схеме показано стрелками). Разъединение (распаривание) электронов, находящихся в одной орбитали, увеличивает валентность на две единицы. Очевидно, хлор и его аналоги (кроме фтора) могут проявлять лишь нечетную переменную валентность 1, 3, 5, 7 и соответствующие положительные степени окисления. У фтора нет свободных орбиталей, а значит, при химических реакциях не происходит разъединения спаренных электронов в атоме. Поэтому при рассмотрении свойств галогенов всегда надо учитывать особенности фтора и соединений.
Водные растворы водородных соединений галогенов являются кислотами: НF - фтороводородная (плавиковая), НСl - хлороводородная (соляная), НВr - бромводородная, НI - йодоводородная.
Одинаковое строение внешнего электронного слоя (ns2np5) обусловливает большое сходство элементов.
При образовании ковалентных связей галогены чаще всего используют один неспаренный р-электрон, имеющийся в невозбужденном атоме, проявляя при этом
Валентные состояния атомов CI, Br, I.
Образуя связи с атомами более электроотрицательных элементов, атомы хлора, брома и йода могут переходить из основного валентного состояния в возбужденные, что сопровождается переходом электронов на вакантные орбитали d-подуровня. При этом число неспаренных электронов увеличивается, вследствие чего атомы CI, Br, I могут образовывать большее число ковалентных связей:
Возбужденные состояния |
Число неспаренных e- |
Валентность |
|
1-е |
ns2np4nd1 |
3 |
III |
2-е |
ns2np3nd2 |
5 |
V |
3-е |
ns1np3nd3 |
7 |
VII |
Отличие F от других галогенов
В атоме F валентные электроны находятся на 2-м энергетическом уровне, имеющем только s- и р- подуровни. Это исключает возможность перехода атомов F в возбужденные состояния, поэтому фтор во всех соединениях проявляет постоянную В, равную I. Кроме того, фтор - самый электроотрицательный элемент, вследствие чего имеет и постоянную с. о. -1.
Важнейшие соединения галогенов
I. Галогеноводороды HHal.
II Галогениды металлов (соли галогеноводородных кислот) - самые многочисленные и устойчивые соединения галогенов
III. Галогенорганические соединения
IV. Кислородсодержащие вещества:
- неустойчивые оксиды, из которых достоверным можно считать существование 6 оксидов (Cl2O, ClO2, Cl2O7, Вr2O, ВrO2, I2O5);
- неустойчивые оксокислоты, из которых только 3 кислоты выделены как индивидуальные вещества (НСlO4, НlO3, НlO4);
- соли оксокислот, главным образом хлориты, хлораты и перхлораты.