Металлы главной подгруппы II группы
4Be 1s22s2
12Mg [Ne]3s2
20Са [Ar]4s2
28Sr [Kr]5s2
56Ba [Xe]6s2
88Ra [Rn]7s2
Общая характеристика подгруппы
Групповое сходство элементов обусловлено наличием 2-х спаренных электронов на внешнем электронном слое и заключается в следующем:
- постоянная валентность II
- постоянная степень окисления +2
- легкость образования 2-зарядных ионов Me+2
С ростом заряда ядра и радиуса атомов свойства элементов закономерно изменяются:
- энергия ионизации Еион уменьшается
- сродство атомов к электрону уменьшается
- электроотрицательность уменьшается
- металлические свойства усиливаются
По важнейшим атомным характеристикам и по физико-химическим свойствам металлов и их соединений наибольшим сходством между собой обладают Са, Sr , Ba , имеющие общее название - щелочноземельные металлы. Эти элементы имеют практически одинаковые значения ЭО, находятся рядом в электрохимическом ряду напряжений; химическая активность в целом от Са к Ва возрастает незначительно; они во многих отношениях сходны со щелочными металлами.
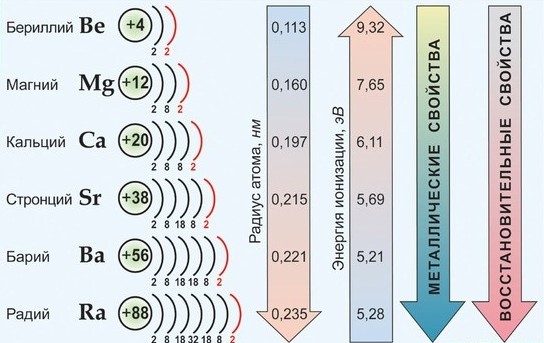
Среди s2-элементов резко выделяется бериллий, который обнаруживает более значительное сходство с алюминием (диагональное сходство). По распространенности в природе и по практической значимости важнейшими элементами являются Са и Mg.
В свободном состоянии в виде простых веществ все s2-элементы - белые твердые вещества с металлическим блеском на срезе, обладающие всеми общими свойствами металлов. Лишь бериллий хрупкий и плохо поддается обработке.
Характеристические соединения
Оксиды |
Гидроксиды |
||||
формула |
характер |
отношение к воде |
формула |
характер |
отношение к воде |
ВеО |
амфотерный |
не растворимый, не взаимодействует |
Ве(ОН)2 Н2ВеO2 |
амфотерный |
не растворимый |
МgО |
основный |
не растворимый, не взаимодействует |
Mg(ОН)2 |
слабое основание |
не растворимый |
СаО |
основные |
хорошо растворимые, взаимодействуют |
Са(ОН)2 |
сильные основания |
мало растворимый |
SrO |
Sr(ОН)2 |
растворимый |
|||
BaO |
Bа(ОН)2 |
растворимый |
|||
Магний
12Mg [Ne]3s2
Ar 24.305
Изотопы 24Mg (78.60 %)
25Mg (10.11 %)
26Mg (11.29 %)
ЭО 1.2
E° -2,37 В
Кларк в земной коре 2,35 % по массе. В свободном виде не встречается. Является одним из самых распространенных породообразующих элементов (более 200 минералов). Основные из них:
- магнезит MgCO3
- доломит СаСО3 • МgСО3
- карналлит КСl • МgСl2 • 6Н2O
- горькая (английская) соль MgS04• 7H2O В виде катионов Mg2+ находится в природных водах (в 1 м3 морской воды содержится около 1 кг Mg2+). Наряду с ионами Са2+обусловливает жесткость воды.
Магний и его соединения играют важную роль в биологических процессах. В качестве комплексообразователя Mg входит в молекулы хлорофилла, а также в другие важные биокомплексы.
Магний - единственный элемент гл. подгр. II группы, применяемый в сравнительно больших количествах в металлическом состоянии (как свободный металл).
Физические свойства
В чистом виде магний - блестящий серебристобелый металл, быстро тускнеющий на воздухе вследствие окисления. Это легкий, относительно мягкий и пластичный металл, легкоплавкий и обладающий хорошей электропроводностью. В сплавах с Al является основным конструкционным материалом в авиа-, судо- и ракетостроении.
Способы получения
1. Электролитический (основной). Электролизу подвергают тщательно обезвоженный расплав хлорида магния (t ≈ 800°C):
MgCl2 = Mg + Cl2↑
2. Карботермический (t ˃ 2000°C)
MgO + С = Mg↑(пары) + СО ↑
Химические свойства
Mg - химически активный металл, особенно в порошкообразном состоянии или в виде ленты. Во всех реакциях магний ведет себя как очень сильный восстановитель:
Mg - 2e- → Mg2+.
Как и другие активные металлы, Mg взаимодействует с кислотами, растворами солей менее активных металлов, со многими неметаллами. Ниже приведены реакции, в которых проявляются некоторые особенности химического поведения магния.
Взаимодействие с кислородом и азотом при горении на воздухе
Реакция сопровождается выделением болышого количества энергии. в т. ч в виде света. При этом ослепительно белое пламя обогащено фотохимически активными лучами (магниевая вспышка).
Происходит одновременное образование оксида и нитрида:
2Мg + О2 = 2МgО
ЗМg + N2 = Mg3N2
Взаимодействие с водой
При обычной температуре Мg с водой не реагирует, так как сразу покрывается плотной пленкой - нерастворимым в воде Мg(ОН)2
1) Мg активно реагирует с кипящей водой:
Мg+ 2Н2O = Мg(ОН)2 + H2↑
2) особенно активно реагирует с водяным паром (Т > 380°С), поэтому совершенно недопустимо тушить горящий Мg водой - это может привести к взрыву.
3) Мд легко растворяется в воде в присутствии NH4CI:
Mg + 2Н2O+ 2NH4Cl = MgCl2 + H2↑ + 2NH3•Н2O
Протеканию реакции способствует кислая среда, образующаяся в результате гидролиза NH4Cl
Взаимодействие с углекислым газом и др. оксидами
Благодаря сильному сродству к кислороду Мg отнимает его у многих оксидов, например, зажженный Мg продолжает гореть в атмосфере CO2 восстанавливая его до свободного углерода:
2Мg + CO2 = 2МgО + С
Взаимодействие с оксидами и солями металлов
См. «Основные способы получения металлов. Магнийтермия».
Взаимодействие с галогенопроизводными УВ (в среде безводного эфира)
Мg + С2Н5Сl → С2Н5-Мg-Сl этилмагнийхлорид
Мg + С6Н5Br → С6Н5-Мg-Br фенилмагнийбромид
Образующиеся Мg-органические соединения носят общее название реактивов Гриньяра и широко используются в органическом синтезе.
Кальций
20Ca [Ar]4s2
Аr 40.08
Основные изотопы:
40Са (96.94 %)
44Са (2.09 %)
422Са (0.667 %)
ЭО 1.0
Е° -2.86 В
Один из основных породообразующих элементов; входит в состав многочисленных минералов в виде соединений:
- СаСО3 (мел, мрамор, известняк)
- СаСО3 • МgСО3 (доломит)
- CaSO4 (ангидрит)
- CaSO4• 2Н2O (гипс)
Химические свойства
Кальций - один из самых активных металлов; во всех реакциях участвует как сильный восстановитель:
Са° - 2e- → Са2+
1 . Взаимодействие с простыми веществами - неметаллами
а) при горении на воздухе образуется преимущественно оксид;
2Са + O2 = 2СаО оксид
б) при Т - 500° частично происходит реакция с азотом:
ЗСа + N2 = Ca3N2 нитрид
Са + Cl2 = CaCI2 хлорид
в) взаимодействие с серой, фосфором, углеродом, кремнием:
Са + S = CaS сульфид
ЗСа + 2Р = Са3Р2 фосфид
Са + 2С = СаС2 карбид
Са + 2Si = CaSi 2 силицид
г) нагревание в струе Н2 сопровождается воспламенением:
Са + Н2 = СаН2 гидрид
2. Взаимодействие с водой и кислотами с выделением Н2
(кроме HF и Н3РO4, из-за нерастворимости фторида CaF2 и фосфата Са3(РO4)2)
Са +2Н2O = Са(ОН)2 + Н2;
Са + 2HCl = СаСl2 + Н2
Са + 2СН3СООН → (СН3СОО)2Са+ H2;
3. Взаимодействие с азотной и концентрированной серной кислотами
4Са +10HNO3(разб) = 4Ca(NO3)2 + NH4NO3 + 3H2O
5Са + 12HNO3(конц) = 5Ca(NO3)2 + N2 + 6Н2O
ЗСа + 4H2SO4(конц) = 3CaSO4 + S + 4Н2O