Металлы главной подгруппы I группы
6 элементов этой подгруппы принято называть щелочными металлами. Это название сложилось исторически, так как Na и К впервые были получены при электролизе щелочей
Общая характеристика металлов главной подгруппы IА группы
|
3Li |
1s2 2s1 |
|
11Na |
[Ne] 3s1 |
|
19К |
[Ar] 4s1 |
|
37Rb |
[Кг] 5s1 |
|
55Cs |
[Xe] 6s1 |
|
87Fr |
[Rn] 7s1 |
все атомы имеют крайне низкие величины энергии сродства к электрону и ЭО.
Элементы данной подгруппы имеют значительное сходство друг с другом, что обусловлено одинаковым строением внешнего электронного слоя атомов и аналогией в их важнейших характеристиках:
— атомы всех элементов на предвнешнем электронном слое имеют устойчивые 8-электронные конфигурации соответствующего благородного газа (у Li — оболочка Не);
— все атомы имеют очень низкие значения Eион и легко превращаются в катионы Me+;
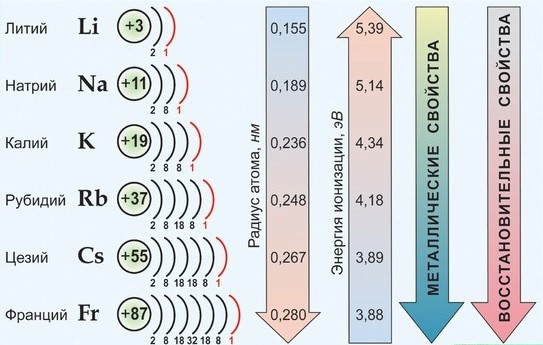
Физические свойства щелочных металлов
В чистом виде щелочные металлы представляют собой легкие, мягкие вещества серебристо-белого цвета на срезе, быстро тускнеющие на воздухе вследствие окисления (цезий имеет золотисто-желтый оттенок). Металлы отличаются высокой электро- и теплопроводностью.
Пары щелочных металлов интенсивно окрашены в различные цвета: Na — пурпурный, К — сине-зеленый, Rb — зеленовато-синий.
Щелочные металлы очень легкоплавки: Cs и Rb плавятся в руках; самый тугоплавкий Li имеет т. пл. 180°С. Плотность этих металлов также невелика — натрий и калий легче воды, а литий плавает даже в керосине.
Щелочные металлы хорошо растворяются в жидком аммиаке, полученные растворы имеют темно-синюю окраску (образуются коллоидные растворы).
Химические свойства
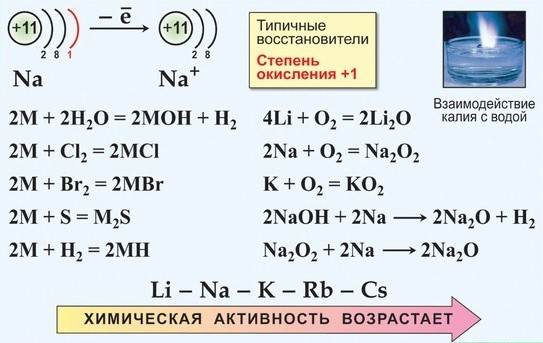
1. Взаимодействие с кислородом
Уже на воздухе щелочные Me немедленно окисляются, a Rb и Cs — самовоспламеняются
При повышении Т все металлы сгорают с образованием ослепительного пламени.
Все щелочные металлы очень химически активны, сильные восстановители:
Me - 1e- → Me+
С активными окислителями, водой и кислотами реакции протекают настолько бурно, что происходит самовоспламенение или взрыв. Часто реакции проводят в охлаждаемой среде. Реакции с неметаллами осуществляют в вакууме или в среде инертных газов.
а) только Li при горении образует нормальный оксид:
4Li + О2 → 2 Li2O
б) Na при горении образует бесцветный или слегка желтоватый пероксид
2Na + O2 → Na2O2
в) К, Rb и Cs сгорают с образованием окрашенных супероксидов:
К + O3= КO3
г) К, Rb и Cs легко реагируют с озоном, образуя озониды:
К + O3= КO3
2. Взаимодействие с галогенами
Соединение щел. Me с галогенами протекает очень бурно, часто в режиме горения, особенно с F2 и Cl2:
2Na + F2 = 2NaF;
2Na + Cl2 = 2NaCl;
2K + Br2 = 2KBr
3. Взаимодействие с другими неметаллами (S, С, Si, Р)
а) все щел. Me реагируют с фосфором и серой (металлы предварительно нагревают):
2Na + S = Na2S сульфид натрия
3Na + Р = Na3Р фосфид натрия
б) с углеродом и кремнием реагирует непосредственно только литий:
2Li + 2С = Li2C2 карбид лития
4. Взаимодействие с водородом
Наиболее легко реакция протекает между водородом и предварительно слабо нагретым литием:
2Li + Н2 = 2LiH
5. Взаимодействие с водой
2Me + 2Н20 —> Н2 + 2МеОН
6. Взаимодействие с кислотами
Реакции протекают очень энергично, даже со слабыми кислотами.
1) реакции с кислотами за счет восстановления ионов Н+:
6Na + 2Н3РО4 = 2Na3P04 + 3H2
2Na + 2HCl = 2NaCl + H2
2) реакции с кислотами за счет восстановления анионов:
8Na + IOHNO3 = 8NaNO3 + NH4NO3 + 3H2O
3) реакции с органическими кислотами:
2 Na + 2СН3СООН → 2 CH3COONa + H2
7. Взаимодействие со спиртами и фенолами
2Na + 2С2Н5ОН → 2C2H5ONa + H2
2Na + 2С6Н5ОН → 2C6H5ONa + H2
8. Взаимодействие с галогеналканами (реакция Вюрца)
CH3Cl + 2Na + ClCH3 → CH3-CH3 + 2NaCI
9. Замещение атомов водорода в гидридах неметаллов
а) реакции с аммиаком расплавленных щелочных металлов:
2Na + 2NH3 = 2NaNH2 + H2
амид натрия
б) реакции с ацетиленом и некоторыми его гомологами
2 Na + НС=СН → NaC =CNa + Н2
ацетиленид натрия
Способы получения
1. Электролиз расплавов солей или щелочей
2NaCI = 2Na + Cl2 (аналогично получают Li , К)
4КОН = 4К + O2 + 2Н2O
Выделение металлов происходит на ртутном, свинцовом или стальном катоде
2. Вакуум-термический способ
Металлы восстанавливают из расплавов их солей активными металлами:
KCl + Na = К + NaCl
2CsCl + Са → 2Cs + CaCl2