Кислород
Кислород (О2) впервые был получен К. Шееле в 1770 г. при нагревании селитры. В 1774 г. Дж. Пристли осуществил получение кислорода разложением оксида ртути.
Характеристика элемента
8О 1s22s22p4; Аr = 15,999 Изотопы: 16O (99,759 %); 17О (0,037 %); 18О (0,204 %); ЭО - 3,5
Кларк в земной коре 47% по массе; в гидросфере 85,82% по массе; в атмосфере 20,95% по объему.
Самый распространенный элемент.
Формы нахождения элемента: а) в свободном виде - О2, О3;
б) в связанном виде: анионы О2- (преимущественно)
Кислород - типичный неметалл, p-элемент. Валентность = II; степень окисления -2 ( за исключением Н2О2, OF2, O2F2)
Физические свойства O2
Молекулярный кислород O2 при обычных условиях находится в газообразном состоянии, не имеет цвета, запаха и вкуса, малорастворим в воде. При глубоком охлаждении под давлением конденсируется в бледно - голубую жидкость (Тkип - 183°С), которая при -219°С превращается в кристаллы сине - голубого цвета.
Способы получения
1. Кислород образуется в природе в поцессе фотосинтеза mCО2 + nH2O → mO2 + Сm(H2O)n
2. Промышленное получение
а) ректификация жидкого воздуха (отделение от N2);
б) электролиз воды: 2H2O → 2Н2↑ + О2↑
3. В лаборатории получают термическим окислительно-восстановительным разложением солей:
а) 2КСlO3 = 3О2↑ + 2KCI
б) 2КМпO4 = О2↑ + МпО2 + К2МпО4↑
в) 2KNO3 = О2↑ + 2KNО2
г) 2Cu(NO3)O2 = О2↑ + 4NО2↑ + 2CuO
д) 2AgNO3 = О2↑ + 2NО2↑ +2Ag
4. В герметически замкнутых помещениях и в аппаратах для автономного дыхания кислород получают реакцией:
2Na2O2 + 2СO2 = О2↑ + 2Na2CO3
Химические свойства кислорода
Кислород - сильный окислитель. По химической активности уступает только фтору. Образует соединения со всеми элементами, кроме Не, Ne и Аг. Непосредственно реагирует с большинством простых веществ при обычных условиях или при нагревании, а также в присутствии катализаторов (исключение - Au, Pt, Hal2, благородные газы). Реакции с участием О2 в большинстве случаев экзотермичны, часто протекают в режиме горения, иногда - взрыва. В результате реакций образуются соединения, в которых атомы кислорода, как правило, имеют С.О. -2:
Окисление щелочных металлов
4Li + О2 = 2Li2O оксид лития
2Na + О2 = Na2О2 пероксид натрия
К + О2 = КО2 супероксид калия
Окисление всех металлов, кроме Au, Pt
Me + О2 = МеxOy оксиды
Окисление неметаллов, кроме галогенов и благородных газов
N2 +О2 = 2NO - Q
S + О2 = SО2;
C + О2 = CО2;
4Р + 5О2 = 2Р2О5
Si + О2 = SiО2
Окисление водородных соединений неметаллов и металлов
4HI + О2 = 2I2 + 2Н2O
2H2S + 3О2 =2SО2 + 2Н2O
4NH3 + 3О2 =2N2 + 6Н2O
4NH3 + 5О2 = 4NO + 6Н2O
2PH3 + 4О2 = P2О5 + 3Н2O
SiH4 + 2О2 = SiО2 + 2Н2O
CxHy + О2 = CО2 + Н2O
MeHx + 3О2 = MexOy + Н2O
Окисление низших оксидов и гидроксидов поливалентных металлов и неметаллов
4FeO + О2 = 2Fe2О3
4Fe(OH)2 +О2 + 2H2O = 4Fe(OH)3
2SО2 + О2 = 2SО3
4NО2 + О2 + 2H2O = 4HNО3
Окисление сульфидов металлов
4FeS2 + 11О2 = 8SО2 + 2Fe2О3
Окисление органических веществ
Все органические соединения горят, окисляясь кислородом воздуха.
Продуктами окисления различных элементов, входящих в их молекулы, являются:
С → CO2
Н → Н2O
Hal → Hal2
N → N2
P → P2O5
S → SO2
Кроме реакций полного окисления (горения) возможны также реакции неполного окисления.
Примеры реакций неполного окисления органических веществ:
1) каталитическое окисление алканов
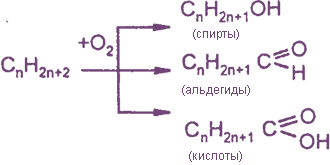
2) каталитическое окисление алкенов
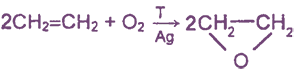
3) окисление спиртов
2R-CH2OH + O2 → 2RCOH + 2Н2O
4) окисление альдегидов
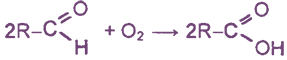
Озон
Озон О3 - более сильный окислитель, чем O2, так как в процессе реакции его молекулы распадаются с образованием атомарного кислорода.
Чистый О3 - газ синего цвета, очень ядовит.
К + О3 = КО3 озонид калия, красного цвета.
PbS + 2О3 = PbSО4 + О2↑
2KI + О3 + Н2O = I2 + 2КОН + О2↑
Последняя реакция используется для качественного и количественного определения озона.