Азотная кислота и нитраты
Азотная кислота HNO3 - бесцветная жидкость, имеет резкий запах, легко испаряется. При попадании на кожу азотная кислота может вызвать сильные ожоги (на коже образуется характерное желтое пятно, его сразу же следует промыть большим количеством воды, а затем нейтрализовать содой NaHCO3)
Азотная кислота
Молекулярная формула: HNO3, B(N) = IV, С.О. (N) = +5
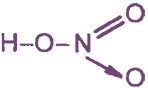
Атом азота образует 3 связи с атомами кислорода по обменному механизму и 1 связь - по донорно-акцепторному механизму.
Физические свойства
Безводная HNO3 при обычной температуре - бесцветная летучая жидкость со специфическим запахом (т. кип. 82,6'С).
Концентрированная «дымящая» HNO3 имеет красный или желтый цвет, так как разлагается с выделением NO2. Азотная кислота смешивается с водой в любых соотношениях.
Способы получения
I. Промышленный - 3-стадийный синтез по схеме: NH3 → NO → NO2 → HNO3
1 стадия: 4NH3 + 5O2 = 4NO + 6H2O
2 стадия: 2NO + O2 = 2NO2
3 стадия: 4NO2 + O2 + 2H2O = 4HNO3
II. Лабораторный - длительное нагревание селитры с конц. H2SO4:
2NaNO3(тв.) +H2SO4(конц.) = 2HNO3 + Na2SO4
Ba(NO3)2(тв) +H2SO4(конц.) = 2HNO3 + BaSO4
Химические свойства
HNO3 как сильная кислота проявляет все общие свойства кислот
HNO3 → H+ + NO3-
HNO3 - очень реакционноспособное вещество. В химических реакциях проявляет себя как сильная кислота и как сильный окислитель.
HNO3 взаимодействует:
а) с оксидами металлов 2HNO3 + CuO = Cu(NO3)2 + H2O
б) с основаниями и амфотерными гидроксидами 2HNO3 + Cu(OH)2 = Cu(NO3)2 + 2H2O
в) с солями слабых кислот 2HNO3 + СaСO3 = Ca(NO3)2 + СO2↑ + H2O
г) с аммиаком HNO3 + NH3 = NH4NO3
Отличие HNO3 от других кислот
1. При взаимодействии HNO3 с металлами практически никогда не выделяется Н2, так как ионы H+ кислоты не участвуют в окислении металлов.
2. Вместо ионов H+ окисляющее действие оказывают анионы NO3-.
3. HNO3 способна растворять не только металлы, расположенные в ряду активности левее водорода, но и малоактивные металлы - Си, Аg, Нg. В смеси с HCl растворяет также Au, Pt.
HNO3 - очень сильный окислитель
I. Окисление металлов:
Взаимодействие HNO3: а) с Me низкой и средней активности: 4HNO3(конц.) + Сu = 2NO2↑ + Cu(NO3)2 + 2H2O
8HNO3(разб.) + ЗСu = 2NO↑ + 3Cu(NO3)2 + 4H2O
б) с активными Me: 10HNO3(разб.) + 4Zn = N2O + 4Zn(NO3)2 + 5H2O
в) с щелочными и щелочноземельными Me: 10HNO3(оч. разб.) + 4Са = NH4NO3 + 4Ca(NO3)2 + 3H2O
Очень концентрированная HNO3 при обычной температуре не растворяет некоторые металлы, в том числе Fe, Al, Cr.
II. Окисление неметаллов:
HNO3 окисляет Р, S, С до их высших С.О., сама при этом восстанавливается до NO (HNO3 разб.) или до NO2 (HNO3 конц ).
5HNO3 + Р = 5NO2↑ + H3PO4 + H2O
2HNO3 + S = 2NO↑ + H2SO4
III. Окисление сложных веществ:
Особенно важными являются реакции окисления сульфидов некоторых Me, которые не растворяются в других кислотах. Примеры:
8HNO3 + PbS = 8NO2↑ + PbSO4 + 4H2O
22HNO3 + ЗСu2S = 10NO↑ + 6Cu(NO3)2 + 3H2SO4 + 8H2O
HNO3 - нитрующий агент в реакциях органического синтеза
R-Н + НО-NO2 → R-NO2 + H2O
Примеры:
С2Н6 + HNO3 → C2H5NO2 + H2O нитроэтан
С6Н5СН3 + 3HNO3 → С6Н2(NO2)3СН3 + ЗH2O тринитротолуол
С6Н5ОН + 3HNO3 → С6Н5(NO2)3OH + ЗH2O тринитрофенол
HNO3 этерифицирует спирты
R-ОН + НO-NO2 → R-O-NO2 + H2O
Примеры:
С3Н5(ОН)3 + 3HNO3 → С3Н5(ONO2)3 + ЗH2O тринитрат глицерина
Разложение HNO3
При хранении на свету, и особенно при нагревании, молекулы HNO3 разлагаются за счет внутримолекулярного окисления-восстановления:
4HNO3 = 4NO2↑ + O2↑ + 2H2O
Выделяется красно-бурый ядовитый газ NO2, который усиливает агрессивно-окислительные свойства HNO3
Соли азотной кислоты - нитраты Me(NO3)n
Нитраты - бесцветные кристаллические вещества, хорошо растворяются в воде. Имеют химические свойства, характерные для типичных солей.
Отличительные особенности:
1) окислительно-восстановительное разложение при нагревании;
2) сильные окислительные свойства расплавленных нитратов щелочных металлов.
Термическое разложение
1. Разложение нитратов щелочных и щелочноземельных металлов:
Me(NO3)n → Me(NO2)n + O2↑
2. Разложение нитратов металлов, стоящих в ряду активности металлов от Mg до Cu:
Me(NO3)n → МеxОy + NO2↑ + O2
3. Разложение нитратов металлов, стоящих в ряду активности металлов превее Cu :
Me(NO3)n → Ме + NO2↑ + O2
Примеры типичных реакций:
1) 2NaNO3 = 2NaNO2 + O2↑
2) 2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
3) 2AgNO3 = 2Ag + 2NO2↑ + O2↑
Окислительное действие расплавов нитратов щелочных металлов
В водных растворах нитраты, в противоположность HNO3, почти не проявляют окислительной активности. Однако расплавы нитратов щелочных металлов и аммония (селитр) являются сильными окислителями, поскольку разлагаются с выделением активного кислорода.