Азотистая кислота и нитриты
Азотистая кислота (HNO3) - неустойчивая, слабая. Она существует только в водных растворах. Соли азотистой кислоты - нитриты - в отличие от самой кислоты устойчивы даже при нагревании.
Азотистая кислота
Молекулярная формула HNО2 B(N) = III, С.О. (N) = +3, графическая формула: Н-О-N=O
HNО2 известна лишь в разбавленных растворах; легко разлагается (при концентрировании р-ров, при нагревании):
2HNО2 = NO + NО2 + Н2O
Кислотные свойства HNО2 выражены довольно слабо - по силе она лишь немного сильнее уксусной кислоты.
Способы получения
I. Растворение оксида азота (III) в воде N2О3 + Н2O = 2HNО2
II. Действие разбавленной серной кислоты на нитриты 2NaNО2 + H2SO4 = Na2SO4 + 2HNО2
Химические свойства
Окислительно-восстановительная двойственность HNО2.
Наряду с общими свойствами слабых кислот, HNО2 проявляет также окислительно-восстановительную активность. Наиболее характерны для нее окислительные свойства, причем восстанавливается она в большинстве случаев до NO; например:
2HNО2 + 2KI + H2SO4 = 2NO↑ + I2 + K2SO4 + 2Н2O
С другой стороны, действием сильных окислителей HNО2 может быть окислена до HNО3:
5HNО2 + 2KMnO4 + 3H2SO4 = 5HNО3 + 2MnSO4 + K2SO4 + 3Н2O
Использование HNО2 в органическом синтезе.
При взаимодействии HNО2 с первичными ароматическими аминами в кислой среде образуются диазониевые соли (реакции диазотирования

С ароматическими аминами и фенолами диазониевые соли вступают в реакцию азосочетания, в результате которой образуются азокрасители (производные азобензола C6H5-N=N-C6H5):
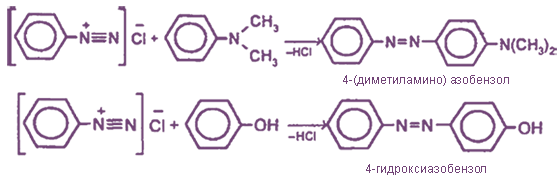
При взаимодействии HNО2 с алифатическими первичными аминами образующиеся диазониевые соли настолько нестабильны, что мгновенно разлагаются с образованием спиртов и выделением азота:
R-NH2 + HO-NO → R-OH + N2↑ + Н2O
Соли азотистой кислоты - нитриты Me(NО2)n
В отличие от самой азотистой кислоты, ее соли - нитриты - устойчивы. Представляют собой кристаллические вещества, хорошо растворимые в воде (труднее других - AgNО2). Наибольшее практическое значение имеют нитриты щелочных металлов - NaNО2 и KNО2. Нитриты токсичны.
Способы получения.
1) Пропускание эквимолярной смеси оксидов азота (II) и (IV) в раствор щелочи:
NO + NО2 + 2NaOH = 2NaNО2 + Н2O
2) Обменные реакции между NaNО2 и солями металлов:
NaNО2 + AgNО3 = AgNО2↓ + NaNО3
3) Разложение нитратов щелочных и щелочноземельных Me:
2KNО3= 2KNО2 + О2↑
Химические свойства.
1) Как и HNО2, нитриты обладают окислительно-восстановительной двойственностью:
KNО2 - восстановитель: KNО2 + Н2О2 = KNО3 + Н2O
3KNО2 + 2КМпO4 + Н2O = 3KNО3 + 2MnО2↓ + 2КОН
KNО2 - окислитель: 2KNО2 + 2KI + 2H2SO4 = 2NO + I2 + 2K2SO4 + 2Н2O
2) Нитрит аммония разлагается при нагревании: NH4NО2 = N2↑ + 2Н2O