Аммиак (нитрид водорода)
Аммиак NH3 - одно из важнейших соединений азота, имеющих большое практическое значение. Раствор аммиака в воде называется аммиачной водой, или нашатырным спиртом.
Строение молекулы NH3
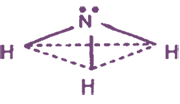
Атом азота образует с атомами водорода 3 полярные ковалентные сигма-связи за счет своих трех неспаренных электронов (B(N) = III, С. О. (N) = -3). Остающаяся неподеленная пара 2s-электронов способна участвовать в образовании 4-й ковалентной связи по донорно-акцепторному механизму с атомами, имеющими вакантную орбиталь
Физические свойства
При обычной температуре NH3 - бесцветный газ с резким запахом, легче воздуха в 1,7 раза. Аммиак очень легко сжижается (т. кип. -ЗЗ'С); жидкий NH3 в некоторых отношениях подобен воде - хороший полярный растворитель, вызывает ионизацию растворенных в нем веществ.
Аммиак очень хорошо растворяется в воде (при 20'С в 1 л Н2О растворяется ~ 700 л NH3). 25%-ный водный раствор называют «нашатырным спиртом».
Между молекулами NH3 и Н2О возникают водородные связи. Поэтому аммиак существует в водном растворе в виде гидрата NH3 • Н2О.
Способы получения
I. Промышленный синтез:
ЗН2 + N2 = 2NH3 + Q
Это один из важнейших процессов в химическом производстве. Реакция очень обратима; для смещения равновесия вправо необходимо очень высокое давление (до 1000 атм).
II. В лабораторных условиях аммиак получают действием щелочей на твердые соли аммония:
2NH4Cl + Са(ОН)2 = 2NH3↑ + CaCl2 + 2Н2О
Химические свойства
NH3 очень реакционноспособное вещество. Реакции с его участием многочисленны и разнообразны по механизмам протекания.
NH3 - сильный восстановитель.
I. Газообразный аммиак взаимодействует:
с кислородом (без катализатора) 4NH3 + 3О2 = 2N2 + 6Н2О
с кислородом (в присутствии катализаторов Pt) 4NH3 + 5О2 = 4NO + 6Н2О
с галогенами 8NH3 + 3Cl2 =N2 + 6NH4Cl
с оксидами малоактивных металлов 2NH3 + ЗСuО = N2 + ЗСu + ЗН2О
II. Растворенный в воде аммиак реагирует с различными окислителями, например:
10NH3 + 6KMnO4 + 9H2SO4 = 5N2↑ + 6MnSO4 + 3K2SO4 + 24Н2О
При окислении аммиака гипохлоритом натрия получают другое водородное соединение азота - гидразин N2H4.
2NH3 + NaOCl = N2H4 + NaCl + Н2О
Водный раствор NH3 - слабое основание.
Образующийся при взаимодействии с водой гидрат аммиака частично диссоциирует:
NH3 + Н2О → NH3 • НОН → NH4+ + ОН-
Комплексный катион NH4+ - продукт присоединения ионов Н+ к молекуле NH3 по донорно-ак-цепторному механизму. За счет освобождающихся из молекул Н2О ионов ОН- раствор аммиака приобретает слабощелочную реакцию и проявляет свойства оснований.
Реакции с кислотами.
Взаимодействует со всеми кислотами, например: NH3 + HNO3 = NH4NO3 нитрат аммония
2NH3 + H2SO4 = (NH4)2SO4 сульфат аммония
NH3 + H2SO4 = NH4HSO4 гидросульфат аммония
Реакции с солями металлов.
При пропускании аммиака в водные растворы солей металлов, гидроксиды которых очень плохо растворяются в воде, происходит осаждение Ме(ОН)x:
3NH3 + ЗН2О + АlСl3 = Al(OH)3↓ +3NH4Cl
NH3 - лиганд в комплексных соединениях (образование аммиакатов).
Молекулы NH3 способны образовывать донорно - акцепторные связи не только с ионами Н+, но и с катионами целого ряда переходных металлов (Аg+, Сu2+, Сr3+, Со2+ и др.).
Это приводит к возникновению комплексных ионов - [Аg(NH3)2] , [Cu(NH3)4], [Cr(NH3)6] и др., которые входят в состав комплексных соединений - аммиакатов.
Благодаря образованию растворимых аммиакатов в водном растворе аммиака растворяются нерастворимые в Н2О оксиды, гидроксиды и соли металлов-комплексообразователей.
В частности, в аммиаке легко растворяются Аg2О, Cu2O, Cu(OH)2, AgCl;
Аg2О + 4NH3 + Н2О = 2 [Аg(NH3)2]OH гидроксид диамминсеребра (I)
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2 гидроксид тетраамминмеди (II)
AgCl + 2NH3 = [Ag(NH3)2]Cl хлорид диамминсеребра (I)
Аммиачные растворы Ag2O, Cu2O, Си(ОН)2 используются как реактивы в качественном анализе (обнаружение альдегидов, многоатомных спиртов).
NH3 - аминирующий агент в органическом синтезе.
Аммиак используют для синтеза алкиламинов, аминокислот и амидов, например:
2NH3 + С2Н5Вr → С2Н5NH2 + NH4Br этиламин
2NH3 + CH2ClCOOH → H2N-CH2-COOH + NH4Cl глицин
Соли аммония
В солях аммония катион NH4+ играет роль катиона щелочного металла (например, К+). Все соли аммония - кристаллические вещества, хорошо растворимые в воде. Некоторые из них окрашены за счет анионов. В водных растворах полностью диссоциируют:
NH4NO3 → NH4+ + NO3-
(NH4)2Cr2O7 → 2NH4+ + Сr2O72-
Способы получения
1. Пропускание аммиака через растворы кислот (см. хим. св-ва NH3).
2. Взаимодействие аммиака с газообразными галогеноводородами: NH3(г.) + НВr (г.) = NH4Br (тв.)
Химические свойства
(специфические для солей аммония)
1.Сильные основания вытесняют NH3 из солей аммония:
NH4Cl + NaOH = NaCl + NH3↑ + Н2О
(NH4)2SO4 + Ba(OH)2 = BaSO4 + 2NH3↑ + 2Н2О
Это качественная реакция на ион NH4+ (выделяющийся NH3 определяют по запаху или по посинению влажной красной лакмусовой бумажки).
2. При нагревании соли аммония разлагаются:
a) при разложении солей аммония, содержащих неокисляющий анион, выделяется NH3:
NH4Cl → NH3↑ + HCl↑
(NH4)2SO4 → NH3↑ + NH4HSO4
(NH4)3PO4 → 3NH3↑ + H3PO4
(NH4)2CO3 → 2NH3↑ + CO2 + Н2О
NH4HCO3 → NH3↑ + CO2 + Н2О;
б) если соль содержит анион-окислитель, то происходит внутримолекулярное окислительно-восстановительное разложение:
NH4NO3 = N2O↑ + 2Н2О
NH4NO2 = N2↑ + 2Н2О
(NH4)2Cr2O7 = N2↑ + Cr2O3 + 4Н2О
3. В водных растворах соли аммония гидролизуются по катиону:
NH4+ + Н2О → NH3 • Н2О +H+