Важнейшие соединения алюминия
- Оксид алюминия Аl2O3 (глинозем);
- Гидроксид алюминия Al(OH)3;
- Соли алюминия.
Из важных свойств Аl2O3 следует отметить следующие:
1) очень твердое вещество (уступает только алмазу и некоторым соединениям бора);
2) аморфный Аl2O3 обладает высокой поверхностной активностью и водопоглощающим свойством - эффективный адсорбент;
3) обладает высокой каталитической активностью,особенно широко используется в органическом синтезе;
4) используется как носитель катализаторов - никеля, платины и др.
В воде он не растворяется и с ней не взаимодействует.
I. Растворяется в кислотах и в щелочах:
1) Аl2O3 + 6HCl = 2AlCl3 + ЗН2O
Al2O3 + 6Н+ = 2Al3+ + ЗН2O
2) Аl2O3 + 2NaOH + ЗН2O = 2Na[Al(OH)4]
Аl2O3 + 20Н- + ЗН2O = 2[Аl(ОН)4]-
II. Сплавляется с твердыми щелочами и оксидами металлов, образуя безводные метаалюминаты:
А2O3 + 2КОН = 2КAlO2 + Н2O
А2O3 + МgО = Мg(AlO)2
Способы получения Аl2O3
1. Извлечение из природных бокситов.
2. Сгорание порошка Al в токе кислорода.
3. Термическое разложение Al(OH)3.
4. Термическое разложение некоторых солей.
4Al(NO3)3 = 2Al2O3 + 12NO2 + 3O2
5. Алюминотермия, например: Fe2O3 + 2Al = Al2O3 + 2Fe
2Al(OH)3 = Al2O3 + ЗН2O
Полученный этим способом Al2O3 называется алюмогелем.
По химическим свойствам - типичный амфотерный гидроксид, растворяется и в кислотах, и в щелочах:
Al(OH)3 + 3HCl = АlСl3+ ЗН2Р
Al(OH)3 + NaOH = Na[Al(OH)4] тетрагидроксоалюмикат натрия
При сплавлении Al(OH)3 с твердыми щелочами образуются метаалюминаты - соли метагидроксида АlO(ОН), которые можно рассматривать как соли метаалюминиевой кислоты НАlO2:
Аl(ОН)3 + NaOH = NaAlO2 + 2Н2O
Соли алюминия
Вследствие амфотерности гидроксида алюминия и возможности существования его в орто- и метаформе существуют различные типы солей. Так как Al(OH)3 проявляет очень слабые кислотные и очень слабые основные свойства, все типы солей в водных растворах в сильной степени подвержены гидролизу, в результате которого образуется в конечном итоге нерастворимый Al(OH)3. Присутствие в водном растворе того или иного типа солей алюминия определяется величиной рН данного раствора.
1. Соли Al3+ с анионами сильных кислот (AlCl3, Al2(SO4)3, Al(NO3)3, АlВr3) существуют в подкисленных растворах. В нейтральной среде метаалюминаты, содержащие алюминий в составе аниона АlO2 существуют в твердом состоянии. Распространены в природе. При растворении в воде превращаются в гидроксоалюминаты.
2. Гидроксоалюминаты, содержащие алюминий в составе аниона [Al(OH)4]-, существуют в щелочных растворах. В нейтральной среде сильно гидролизуются.
3. Метаалюминаты, содержащие алюминий в составе аниона АlO2. Существуют в твердом состоянии. Распространены в природе. При растворении в воде превращаются в гидроксоалюминаты.
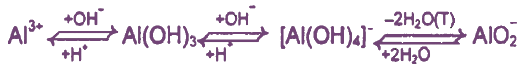
Способы осаждения (получения) Аl(ОН)3 из растворов его солей
I. Осаждение из растворов, содержащих соли Al3+:
а) действие сильных щелочей, добавленных без избытка
АlСl3 + 3NaOH = Аl(ОН)3↓ + ЗН2O
б) действие водных растворов аммиака (слабое основание)
АlСl3 + 3NH3 + ЗН2O = Аl(ОН)3↓ + 3NH4Cl
в) действие солей очень слабых кислот, растворы которых вследствие гидролиза имеют щелочную среду (избыток ОН-)
2АlСl3 + 3Na2CO3 + 3Н2O = Аl(ОН)3↓ + ЗСО2↑ + 6NaCl
Al2(SO4)3 + 3K2S + 6Н2O = 2Аl(ОН)3↓ + 3K2SO4 + 3H2S↑
II. Осаждение из растворов, содержащих гидроксоалюминаты:
а) действие сильных кислот, добавленных
Na[Аl(ОН)4] + HCl = Аl(ОН)3↓ + NaCl + Н2O
2[Аl(ОН)4] + H2SO4 = 2Аl(ОН)3↓ + Na2SO4+ 2Н2O
б) действие слабых кислот, например, пропускание СО2
Na[Аl(ОН)4] + СО2 = Аl(ОН)3↓ + NaHСО3
III. Осаждение в результате обратимого или необратимого гидролиза солей Al3+ (усиливается при разбавлении раствора водой и при нагревании)
а) обратимый гидролиз
Al3+ + Н2O = Al(OH)2+ + H+
Al3+ + 2Н2O = Аl(ОН)2+ + 2H+
Al3+ + 3Н2O = Аl(ОН)3+ + 3H+
б) необратимый гидролиз
Al2S3 + 6H2O = 2Аl(ОН)3↓ + 3H2S↑