Окислительно-восстановительные реакции. Окисление, восстановление.
К таковым относят реакции, в которых реагирующие вещества обмениваются электронами, изменяя при этом степени окисления атомов элементов, входящих в состав реагирующих веществ.
Например:
Zn + 2H+ → Zn2+ + H2↑,
FeS2 + 8HNO3(конц) = Fe(NO3)3 + 5NO↑ + 2H2SO4 + 2H2O,
Подавляющее большинство химических реакций относятся к окислительно-восстановительным, они играют исключительно важную роль.
Если атом отдает свои электроны, то он приобретает положительный заряд:
Например:
Al - 3e- = Al3+
H2 - 2e- = 2H+
При окислении степень окисления повышается.
Если отрицательно заряженный ион (заряд -1), например Cl-, отдает 1 электрон, то он становится нейтральным атомом:
2Cl- - 2e- = Cl2
Если положительно заряженный ион или атом отдает электроны, то величина его положительного заряда увеличивается соответственно числу отданных электронов:
Fe2+ - e- = Fe3+
Если атом присоединяет электроны, то он превращается в отрицательно заряженный ион:
Например:
Сl2 + 2е- = 2Сl-
S + 2е- = S2-
Если положительно заряженный ион принимает электроны, то величина его заряда уменьшается:
Fe3+ + e- = Fe2+
или он может перейти в нейтральный атом:
Fe2+ + 2e- = Fe0
Окисление всегда сопровождается восстановлением, и наоборот, восстановление всегда связано с окислением, что можно выразить уравнениями:
Восстановитель - е- ↔ Окислитель
Окислитель + е- ↔ Восстановитель
Поэтому окислительно-восстановительные реакции представляют собой единство двух противоположных процессов - окисления и восстановления
Важнейшие восстановители и окислители
|
Восстановители |
Окислители |
Металлы, водород, уголь Оксид углерода(II) CO Сероводород H2S, оксид серы(IV) SO2, сернистая кислота H2SO3 и ее соли Иодоводородная кислота HI, бромоводородная кислота HBr, соляная кислота HCl Хлорид олова(II) SnCl2, сульфат железа(II) FeSO4, сульфат марганца(II) MnSO4, сульфат хрома(III) Cr2(SO4)3 Азотистая кислота HNO2, аммиак NH3, гидразин N2H4, оксид азота(II) NO Фосфористая кислота H3PO3 Альдегиды, спирты, муравьиная и щавелевая кислоты, глюкоза Катод при электролизе |
Галогены Перманганат калия KMnO4 , манганат калия K2MnO4 , оксид марганца(IV) MnO2 Дихромат калия K2Cr2O7 , хромат калия K2CrO4 Азотная кислота HNO3 Кислород O2, озон О3, пероксид водорода Н2О2 Серная кислота H2SO4(конц.), селеновая кислота H2SeO4 Оксид меди(II) CuO, оксид серебра(I) Ag2O, оксид свинца(IV) PbO2 Ионы благородных металлов (Ag+, Au 3+ и др.) Хлорид железа(III) FeCl3 Гипохлориты, хлораты и перхлораты Царская водка, смесь концентрированной азотной и плавиковой кислот Анод при электролизе |
Метод электронного баланса.
Для уравнивания ОВР используют несколько способов, из которых мы пока рассмотрим один - метод электронного баланса.
Напишем уравнение реакции между алюминием и кислородом:
Al + O2 = Al2O3
Пусть вас не вводит в заблуждение простота этого уравнения. Наша задача - разобраться в методе, который в будущем позволит вам уравнивать гораздо более сложные реакции.
Итак, в чем заключается метод электронного баланса? Баланс - это равенство. Поэтому следует сделать одинаковым количество электронов, которые
Al0 + O20 = Al2+3O3-2
Алюминий отдает электроны (приобретает положительную степень окисления), а кислород - принимает электроны (приобретает отрицательную степень окисления). Чтобы получить степень окисления +3, атом алюминия должен отдать 3 электрона. Молекула кислорода, чтобы превратиться в кислородные атомы со степенью окисления -2, должна принять 4 электрона:
Al0 - 3e- = Al+3
O20 + 4e- = 2O-2
Чтобы количество отданных и принятых электронов выровнялось, первое уравнение надо умножить на 4, а второе - на 3. Для этого достаточно переместить числа отданных и принятых электронов против верхней и нижней строчки так, как показано на схеме вверху.
Если теперь в уравнении перед восстановителем (Al) мы поставим найденный нами коэффициент 4, а перед окислителем (O2) - найденный нами коэффициент 3, то количество отданных и принятых электронов выравнивается и становится равным 12. Электронный баланс достигнут. Видно, что перед продуктом реакции Al2O3 необходим коэффициент 2. Теперь уравнение окислительно-восстановительной реакции уравнено:
4Al + 3O2 = 2Al2O3
Все преимущества метода электронного баланса проявляются в более сложных случаях, чем окисление алюминия кислородом.
K+Mn+7O4-2 + K+Cl- + H2SO4 = Cl20 + Mn+2SO4 + K2SO4 + H2O
Составим схему электронного баланса:
Mn+7 + 5e- = Mn+2
2Cl- - 2e- = Cl20
Двойка и пятерка - главные коэффициенты уравнения, благодаря которым удается легко подобрать все другие коэффициенты. Перед Cl2 следует поставить коэффициент 5 (или 2 × 5 = 10 перед KСl), а перед KMnO4 - коэффициент 2. Все остальные коэффициенты привязывают к этим двум коэффициентам. Это гораздо легче, чем действовать простым перебором чисел.
Чтобы уравнять количество атомов К (12 атомов слева), надо перед K2SO4 в правой части уравнения поставить коэффициент 6. Наконец, чтобы уравнять кислород и водород, достаточно перед H2SO4 и H2O поставить коэффициент 8. Мы получили уравнение в окончательном виде.
Метод электронного баланса, как мы видим, не исключает и обыкновенного подбора коэффициентов в уравнениях окислительно-восстановительных реакций, но может заметно облегчить такой подбор.
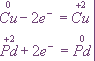
из которых следует, что при восстановителе и окислителе коэффициенты равны 1. Окончательное уравнение реакции:
Cu + Pd(NO3)2 = Cu(NO3)2 + Pd
Как видно, в суммарном уравнении реакции электроны не фигурируют.
Чтобы проверить правильность составленного уравнения, подсчитываем число атомов каждого элемента в его правой и левой частях. Например, в правой части 6 атомов кислорода, в левой также 6 атомов; палладия 1 и 1; меди тоже 1 и 1. Значит, уравнение составлено правильно.
Переписываем это уравнение в ионной форме:
Cu + Pd2+ + 2NO3- = Cu2+ + 2NO3- + Рd
И после сокращения одинаковых ионов получим
Cu + Pd2+ = Cu2+ + Рd
Составление уравнения реакции взаимодействия оксида марганца (IV) с концентрированной соляной кислотой
(с помощью этой реакции в лабораторных условиях получают хлор).
Запишем формулы исходных и конечных веществ реакции:
НCl + МnО2 → Сl2 + MnСl2 + Н2О
Покажем изменение степеней окисления атомов до и после реакции:
Эта реакция окислительно-восстановительная, так как изменяются степени окисления атомов хлора и марганца. НCl - восстановитель, MnО2 - окислитель. Составляем электронные уравнения:
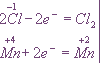
и находим коэффициенты при восстановителе и окислителе. Они соответственно равны 2 и 1. Коэффициент 2 (а не 1) ставится потому, что 2 атома хлора со степенью окисления -1 отдают 2 электрона. Этот коэффициент уже стоит в электронном уравнении:
2НСl + MnO2 → Сl2 + MnСl2 + Н2О
Находим коэффициенты для других реагирующих веществ. Из электронных уравнений видно, что на 2 моль HCl приходится 1 моль MnО2. Однако, учитывая, что для связывания образующегося двухзарядного иона марганца нужно еще 2 моль кислоты, перед восстановителем следует поставить коэффициент 4. Тогда воды получится 2 моль. Окончательное уравнение имеет вид
4НCl + МnО2 = Сl2 + MnСl2 + 2Н2О
Проверку правильности написания уравнения можно ограничить подсчетом числа атомов одного какого-либо элемента, например хлора: в левой части 4 и в правой 2 + 2 = 4.
Поскольку в методе электронного баланса изображаются уравнения реакций в молекулярной форме, то после составления и проверки их следует написать в ионной форме.
Перепишем составленное уравнение в ионной форме:
4Н+ + 4Сl- + МnО2 = Сl2 + Мn2+ + 2Сl- + 2Н2О
и после сокращения одинаковых ионов в обеих частях уравнения получим
4Н+ + 2Сl- + МnО2 = Сl2 + Мn2+ + 2Н2О
Составление уравнения реакции взаимодействия сероводорода с подкисленным раствором перманганата калия.
Напишем схему реакции - формулы исходных и полученных веществ:
Н2S + КМnO4 + Н2SО4 → S + МnSО4 + К2SO4 + Н2О
Затем покажем изменение степеней окисления атомов до и после реакции:
Изменяются степени окисления у атомов серы и марганца (Н2S - восстановитель, КМnО4 - окислитель). Составляем электронные уравнения, т.е. изображаем процессы отдачи и присоединения электронов:
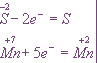
И наконец, находим коэффициенты при окислителе и восстановителе, а затем при других реагирующих веществах. Из электронных уравнений видно, что надо взять 5 моль Н2S и 2 моль КМnО4, тогда получим 5 моль атомов S и 2 моль МnSО4. Кроме того, из сопоставления атомов в левой и правой частях уравнения, найдем, что образуется также 1 моль К2SО4 и 8 моль воды. Окончательное уравнение реакции будет иметь вид
5Н2S + 2КМnО4 + ЗН2SО4 = 5S + 2МnSО4 + К2SО4 + 8Н2О
Правильность написания уравнения подтверждается подсчетом атомов одного элемента, например кислорода; в левой части их 2 • 4 + 3 • 4 = 20 и в правой части 2 • 4 + 4 + 8 = 20.
Переписываем уравнение в ионной форме:
5Н2S + 2MnO4- + 6H+ = 5S + 2Мn2+ + 8Н2О
Известно, что правильно написанное уравнение реакции является выражением закона сохранения массы веществ. Поэтому число одних и тех же атомов в исходных веществах и продуктах реакции должно быть одинаковым. Должны сохраняться и заряды. Сумма зарядов исходных веществ всегда должна быть равна сумме зарядов продуктов реакции.
Метод электронно-ионного баланса более универсален по сравнению с методом электронного баланса и имеет неоспоримое преимущество при подборе коэффициентов во многих окислительно-восстановительных реакциях, в частности, с участием органических соединений, в которых даже процедура определения степеней окисления является очень сложной.
Классификация ОВР
Различают три основных типа окислительно-восстановительных реакций:
(когда окислитель и восстановитель - разные вещества);
(когда окислителем и восстановителем может служить одно и то же вещество);
(когда одна часть молекулы выступает в роли окислителя, а другая - в роли восстановителя).>
Рассмотрим примеры реакций трех типов.
Рассмотрим несколько более сложный случай, когда не весь окислитель может быть израсходован в реакции, поскольку часть его участвует в обычной - не окислительно-восстановительной реакции обмена:
Cu0 + H+N+5O3-2 = Cu+2(N+5O3-2)2+ N+2O-2 + H2O
Часть частиц NO3- участвует в реакции в качестве окислителя, давая оксид азота NO, а часть ионов NO3- в неизменном виде переходит в соединение меди Cu(NO3)2. Составим электронный баланс:
Cu0 - 2e- = Cu+2
N+5+ 3e- = N+2
Поставим найденный для меди коэффициент 3 перед Cu и Cu(NO3)2. А вот коэффициент 2 следует поставить только перед NO, потому что весь имеющийся в нем азот участвовал в окислительно-восстановительной реакции. Было бы ошибкой поставить коэффициент 2 перед HNO3, потому что это вещество включает в себя и те атомы азота, которые не участвуют в окислении-восстановлении и входят в состав продукта Cu(NO3)2 (частицы NO3- здесь иногда называют "ионом-наблюдателем").
Остальные коэффициенты подбираются без труда по уже найденным:
Следовательно, степень окисления способна как понижаться, так и повышаться. Например:
HN+3O2 = HN+5O3 + N+2O + H2O
Эту реакцию можно представить как реакцию между HNO2 и HNO2 как окислителем и восстановителем и применить метод электронного баланса:
HN+3O2 + HN+3O2 = HN+5O3 + N+2O + H2O
N+3 - 2e- = N+5
N+3 + e- = N+2
Получаем уравнение:
2HNO2 + 1HNO2 =
Или, складывая вместе моли HNO2:
3HNO2 = HNO3 + 2NO + H2O
KCl+5O3-2 = KCl- + O20
Это уравнение также подчиняется требованию электронного баланса:
Cl+5 + 6e- = Cl-
2O-2 - 2e- = O20
Здесь возникает сложность - какой из двух найденных коэффициентов поставить перед KClO3 - ведь эта молекула содержит и окислитель и восстановитель?
В таких случаях найденные коэффициенты ставятся перед продуктами:
KClO3 = 2KCl + 3O2
Теперь ясно, что перед KClO3 надо поставить коэффициент 2.
2KClO3 = 2KCl + 3O2
Внутримолекулярная реакция разложения бертолетовой соли при нагревании используется при получении кислорода в лаборатории.
Метод полуреакций
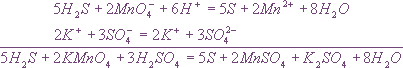
Как показывает само название, этот метод основан на составлении ионных уравнений для процесса окисления и процесса восстановления с последующим суммированием их в общее уравнение.
В качестве примера составим уравнение той же реакции, которую использовали при объяснении метода электронного баланса.
При пропускании сероводорода Н2S через подкисленный раствор перманганата калия КМnО4 малиновая окраска исчезает и раствор мутнеет.
Опыт показывает, что помутнение раствора происходит в результате образования элементной серы, т.е. протекания процесса:
Н2S → S + 2H+
Эта схема уравнена по числу атомов. Для уравнивания по числу зарядов надо от левой части схемы отнять два электрона, после чего можно стрелку заменить на знак равенства:
Н2S - 2е- = S + 2H+
Это первая полуреакция - процесс окисления восстановителя Н2S.
Обесцвечивание раствора связано с переходом иона MnO4- (он имеет малиновую окраску) в ион Mn2+ (практически бесцветный и лишь при большой концентрации имеет слабо-розовую окраску), что можно выразить схемой
MnO4- → Mn2+
В кислом растворе кислород, входящий в состав ионов МnО4, вместе с ионами водорода в конечном итоге образует воду. Поэтому процесс перехода записываем так:
MnO4- + 8Н+ → Мn2+ + 4Н2О
Чтобы стрелку заменить на знак равенства, надо уравнять и заряды. Поскольку исходные вещества имеют семь положительных зарядов (7+), а конечные - два положительных (2+), то для выполнения условия сохранения зарядов надо к левой части схемы прибавить пять электронов:
MnO4- + 8Н+ + 5e- = Mn2+ + 4Н2О
Это вторая полуреакция - процесс восстановления окислителя, т.е. перманганат-иона
Для составления общего уравнения реакции надо уравнения полуреакций почленно сложить, предварительно уравняв числа отданных и полученных электронов. В этом случае по правилам нахождения наименьшего кратного определяют соответствующие множители, на которые умножаются уравнения полуреакций. Сокращенно запись проводится так:
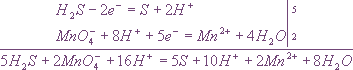
И, сократив на 10Н+, окончательно получим
5Н2S + 2MnO4- + 6H+ = 5S + 2Mn2+ + 8Н2О
Проверяем правильность составленного в ионной форме уравнения: число атомов кислорода в левой части 8, в правой 8; число зарядов: в левой части (2-)+(6+) = 4+, в правой 2(2+) = 4+. Уравнение составлено правильно, так как атомы и заряды уравнены.
Методом полуреакций составляется уравнение реакции в ионной форме. Чтобы от него перейти к уравнению в молекулярной форме, поступаем так: в левой части ионного уравнения к каждому аниону подбираем соответствующий катион, а к каждому катиону - анион. Затем те же ионы в таком же числе записываем в правую часть уравнения, после чего ионы объединяем в молекулы:
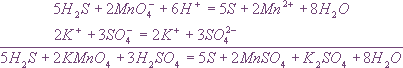
Таким образом, составление уравнений окислительно-восстановительных реакций с помощью метода полуреакций приводит к тому результату, что и метод электронного баланса.
Сопоставим оба метода. Достоинство ыметода полуреакций по сравнению с методом электронного баланса в том. что в нем применяются не гипотетические ионы, а реально существующие. В самом деле, в растворе нет ионов ![]() , а есть ионы
, а есть ионы ![]() .
.
При методе полуреакций не нужно знать степень окисления атомов.
Написание отдельных ионных уравнений полуреакций необходимо для понимания химических процессов в гальваническом элементе и при электролизе. При этом методе видна роль среды как активного участника всего процесса. Наконец, при использовании метода полуреакций не нужно знать все получающиеся вещества, они появляются в уравнении реакции при выводе его. Поэтому методу полуреакций следует отдать предпочтение и применять его при составлении уравнений всех окислительно-восстановительных реакций, протекающих в водных растворах.