Реакции ионного обмена
Поскольку электролиты в растворах образуют ионы, то для отражения сущности реакций часто используют так называемые
Ионные уравнения реакций.
Написанием ионных уравнений подчеркивается тот факт, что, согласно теории диссоциации, в растворах происходят реакции не между молекулами, а между ионами.
С точки зрения теории диссоциации при реакциях между ионами в растворах электролитов возможны два исхода:
1. Образующиеся вещества - сильные электролиты, хорошорастворимые в воде и полностью диссоциирующие на ионы.
2. Одно (или несколько) из образующихся веществ - газ, осадок или слабый электролит (хорошо растворимый в воде).
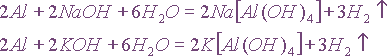
В ионной форме эти уравнения запишутся следующим образом:
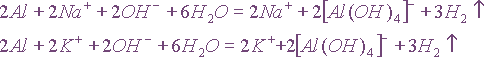
В данном случае алюминий не является электролитом, а молекула воды записывается в не диссоциированной форме потому, что является очень слабым электролитом. Неполярные молекулы водорода практически нерастворимы в воде и удаляются из сферы реакции. Одинаковые ионы в обеих частях уравнений можно сократить, и тогда эти уравнения преобразуются в одно сокращенное ионное уравнение взаимодействия алюминия с щелочами:
Очевидно, что при взаимодействии алюминия с любой щелочью реакция будет описываться уравнением. Следовательно,
С учетом вышеизложенного можно сформулировать правило, которым удобно руководствоваться при изучении процессов, протекающих в растворах электролитов.
Следовательно, реакции идут с образованием веществ с меньшей концентрацией ионов в растворе в соответствии с законом действующих масс. Скорость прямой реакции пропорциональна произведению концентраций ионов реагирующих компонентов, а скорость обратной реакции пропорциональна произведению концентраций ионов продуктов. Но при образовании газов, осадков и слабых электролитов ионы связываются (уходят из раствора) и скорость обратной реакции уменьшается.
Согласно теории электролитической диссоциации все реакции в водных растворах электролитов являются реакциями между ионами. Они называются ионными реакциями , а уравнения этих реакций - ионными уравнениями . Они проще уравнений реакций, записанных в молекулярной форме, и имеют более общий характер.
При составлен ии ио нных уравнений реакций следует руководствоваться тем,что вещества малодиссоциированные , малорастворимые (выпадающиев осадок) и газообразные записываются в молекулярной форме. Знак ↓ , стоящий при формуле вещества,обозначает, что это вещество уходит из сферы реакции в виде осадка, знак ↑ обозначает, что вещество удаляется изсферы реакции в виде газа. Сильные электролиты, как полностью диссоциированные,записывают в виде ионов. Сумма электрических зарядов левой части уравнениядолжна быть равна сумме электрических зарядов правой части.
Примеры решения задач.
Для закрепления этих положений рассмотрим два примера.
Разобьем решение задачи на четыре этапа.
1. Запишем уравнение реакции в молекулярной форме:
FeCl + 3NaOH = Fe(OH)3 + 3NaCl
2. Перепишем это уравнение, изобразив хорошо диссоциирующие вещества в виде молекул:
FeЗ+ + 3Cl- + 3N а++ 3ОН- = Fе(ОН)3↓ +3N а++ 3Cl-
Это ионное уравнение реакции.
3. Исключим из обеих частей ионного уравнения одинаковые ионы, т.е. ионы, не участвующие в реакции (они подчеркнуты):
Fe3++ 3Cl-+ 3Na-+ 3ОН- = Fе(ОН)3↓ + 3Na++ 3Cl-.
4. Запишем уравнение реакции в окончательном виде:
Fe3++ 3ОН- = Fe(OH)3↓
Это сокращенное ионное уравнение реакции. Как видно из этого уравнения, сущность реакции сводится к взаимодействию ионов Fe3+ и ОН-, в результате чего образуется осадок Fе(ОН)3. При этом вовсе не имеет значения, в состав каких электролитов входили эти ионы до их взаимодействия.
Так как продукты взаимодействия хорошо растворимы в воде и не уходят из сферы реакции, то данная реакция обратима.
Как и в примере 1, записываем по этапам:
KCl + NaNO3 = KNO3 + NaCl
K++ Cl-+ Na++ NO-3 = K++ NO-3+ Na++ Cl-
Уравнения для следующих этапов написать нельзя, так как с точки зрения теории электролитической диссоциации реакция не происходит. Однако если выпаривать этот раствор, то будут возникать новые химические связи между ионами и получится смесь четырех солей: КСl, NаNО3, NaСl, КNO 3.
Ионными уравнениями могут быть изображены любые реакции, протекающие в растворах между электролитами. Если при таких реакциях не происходит изменения зарядов ионов (не изменяется степень окисления), то они называются